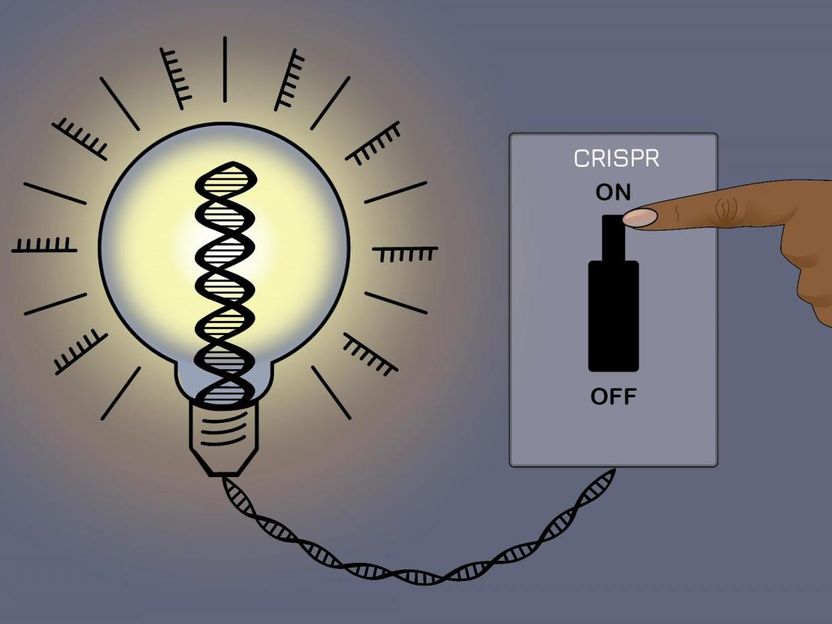
Un interruptor de encendido y apagado para la edición de genes
Un nuevo método CRISPR reversible puede controlar la expresión de los genes sin modificar la secuencia de ADN subyacente
En la última década, el sistema de edición genética CRISPR-Cas9 ha revolucionado la ingeniería genética, permitiendo a los científicos realizar cambios específicos en el ADN de los organismos. Aunque el sistema podría ser útil para tratar diversas enfermedades, la edición CRISPR-Cas9 implica el corte de cadenas de ADN, lo que provoca cambios permanentes en el material genético de la célula.
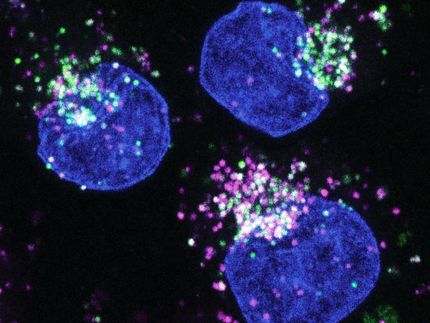
Un nuevo método CRISPR permite a los investigadores silenciar la mayoría de los genes del genoma humano sin alterar la secuencia de ADN subyacente, y luego revertir los cambios.
Jennifer Cook-Chrysos/Whitehead Institute
Ahora, en un artículo publicado en línea en Cell el 9 de abril, los investigadores describen una nueva tecnología de edición de genes llamada CRISPRoff que permite a los investigadores controlar la expresión de los genes con gran especificidad dejando la secuencia del ADN sin cambios. Diseñado por el miembro del Instituto Whitehead Jonathan Weissman, el profesor asistente de la Universidad de California en San Francisco Luke Gilbert, el postdoc del laboratorio de Weissman James Nuñez y colaboradores, el método es lo suficientemente estable como para ser heredado a través de cientos de divisiones celulares, y también es totalmente reversible.
"La gran historia es que ahora tenemos una herramienta sencilla que puede silenciar la gran mayoría de los genes", dice Weissman, que también es profesor de biología en el MIT e investigador del Instituto Médico Howard Hughes. "Podemos hacerlo para múltiples genes al mismo tiempo sin ningún daño en el ADN, con gran homogeneidad y de forma reversible. Es una gran herramienta para controlar la expresión genética".
El proyecto fue parcialmente financiado por una subvención de 2017 de la Agencia de Proyectos de Investigación Avanzada de Defensa para crear un editor de genes reversible. "Avancemos rápidamente cuatro años [desde la subvención inicial], y CRISPRoff finalmente funciona como se imaginó en una forma de ciencia ficción", dice el coautor Gilbert. "Es emocionante ver que funciona tan bien en la práctica".
Ingeniería genética 2.0
El sistema clásico CRISPR-Cas9 utiliza una proteína de corte de ADN llamada Cas9 que se encuentra en los sistemas inmunitarios bacterianos. El sistema puede dirigirse a genes específicos de células humanas mediante un único ARN guía, en el que las proteínas Cas9 crean pequeñas roturas en la cadena de ADN. A continuación, la maquinaria de reparación existente en la célula repara los agujeros.
Como estos métodos alteran la secuencia de ADN subyacente, son permanentes. Además, su dependencia de los mecanismos de reparación celular "internos" significa que es difícil limitar el resultado a un único cambio deseado. "Por muy bonito que sea CRISPR-Cas9, deja la reparación en manos de los procesos celulares naturales, que son complejos y multifacéticos", afirma Weissman. "Es muy difícil controlar los resultados".
Ahí es donde los investigadores vieron una oportunidad para un tipo diferente de editor de genes: uno que no alterara las secuencias de ADN en sí, sino que cambiara la forma en que se leen en la célula.
Este tipo de modificación es lo que los científicos denominan "epigenética": los genes pueden silenciarse o activarse a partir de cambios químicos en la cadena de ADN. Los problemas con la epigenética de una célula son responsables de muchas enfermedades humanas, como el síndrome del cromosoma X frágil y varios tipos de cáncer, y pueden transmitirse de generación en generación.
El silenciamiento epigenético de los genes suele producirse a través de la metilación -la adición de etiquetas químicas a determinados lugares de la cadena de ADN-, que hace que el ADN se vuelva inaccesible para la ARN polimerasa, la enzima que lee la información genética de la secuencia de ADN en transcripciones de ARN mensajero, que en última instancia pueden ser los planos de las proteínas.
Weissman y sus colaboradores ya habían creado otros dos editores epigenéticos llamados CRISPRi y CRISPRa, pero ambos tenían una advertencia. Para que funcionaran en las células, éstas debían expresar continuamente proteínas artificiales para mantener los cambios.
"Con esta nueva tecnología CRISPRoff, se puede [expresar brevemente una proteína] para escribir un programa que sea recordado y llevado a cabo indefinidamente por la célula", dice Gilbert. "Cambia el juego, así que ahora básicamente estás escribiendo un cambio que se transmite a través de las divisiones celulares - de alguna manera podemos aprender a crear una versión 2.0 de CRISPR-Cas9 que es más segura e igual de eficaz, y puede hacer todas estas otras cosas también".
Construir el interruptor
Para construir un editor epigenético que pudiera imitar la metilación natural del ADN, los investigadores crearon una diminuta máquina proteica que, guiada por pequeños ARN, puede fijar grupos metilo en puntos específicos de la cadena. Estos genes metilados son entonces "silenciados" o apagados, de ahí el nombre de CRISPRoff.
Como el método no altera la secuencia de la cadena de ADN, los investigadores pueden revertir el efecto de silenciamiento utilizando enzimas que eliminen los grupos metilo, un método que denominaron CRISPRon.
Al probar el CRISPRoff en diferentes condiciones, los investigadores descubrieron algunas características interesantes del nuevo sistema. Por un lado, podían dirigir el método a la gran mayoría de los genes del genoma humano, y no sólo funcionaba con los propios genes, sino también con otras regiones del ADN que controlan la expresión de los genes pero no codifican proteínas. "Eso fue una gran sorpresa incluso para nosotros, porque pensábamos que sólo iba a ser aplicable a un subconjunto de genes", dice el primer autor, Núñez.
Además, sorprendentemente para los investigadores, CRISPRoff fue capaz incluso de silenciar genes que no tenían grandes regiones metiladas llamadas islas CpG, que hasta ahora se consideraban necesarias para cualquier mecanismo de metilación del ADN.
"Lo que se pensaba antes de este trabajo era que el 30 por ciento de los genes que no tienen una isla CpG no estaban controlados por la metilación del ADN", dice Gilbert. "Pero nuestro trabajo muestra claramente que no se necesita una isla CpG para desactivar los genes por metilación. Eso, para mí, fue una gran sorpresa".
CRISPRoff en la investigación y la terapia
Para investigar el potencial de CRISPRoff en aplicaciones prácticas, los científicos probaron el método en células madre pluripotentes inducidas. Se trata de células que pueden convertirse en innumerables tipos de células en el cuerpo dependiendo del cóctel de moléculas al que se exponen, por lo que son potentes modelos para estudiar el desarrollo y la función de determinados tipos de células.
Los investigadores eligieron un gen para silenciarlo en las células madre y luego las indujeron a convertirse en células nerviosas llamadas neuronas. Cuando buscaron el mismo gen en las neuronas, descubrieron que había permanecido silenciado en el 90 por ciento de las células, lo que revela que las células conservan una memoria de las modificaciones epigenéticas realizadas por el sistema CRISPRoff incluso cuando cambian de tipo celular.
También seleccionaron un gen para utilizarlo como ejemplo de cómo CRISPRoff podría aplicarse a la terapéutica: el gen que codifica la proteína Tau, implicada en la enfermedad de Alzheimer. Tras probar el método en neuronas, pudieron demostrar que el uso de CRISPRoff podía servir para reducir la expresión de Tau, aunque no para desactivarla por completo. "Lo que demostramos es que se trata de una estrategia viable para silenciar a Tau y evitar que esa proteína se exprese", afirma Weissman. "La pregunta es, entonces, ¿cómo se administra esto a un adulto? ¿Y sería realmente suficiente para influir en el Alzheimer? Son grandes preguntas abiertas, especialmente esta última".
Incluso si CRISPRoff no conduce a terapias contra el Alzheimer, hay muchas otras condiciones a las que podría aplicarse. Y aunque la administración en tejidos específicos sigue siendo un reto para las tecnologías de edición de genes como CRISPRoff, "demostramos que se puede administrar transitoriamente como ADN o como ARN, la misma tecnología que es la base de la vacuna contra el coronavirus de Moderna y BioNTech", afirma Weissman.
Weissman, Gilbert y sus colaboradores están entusiasmados con el potencial de CRISPRoff para la investigación. "Como ahora podemos silenciar cualquier parte del genoma que queramos, es una gran herramienta para explorar la función del genoma", dice Weissman.
Además, disponer de un sistema fiable para alterar la epigenética de una célula podría ayudar a los investigadores a conocer los mecanismos por los que las modificaciones epigenéticas se transmiten a través de las divisiones celulares. "Creo que nuestra herramienta nos permite empezar a estudiar el mecanismo de la heredabilidad, especialmente la heredabilidad epigenética, que es una cuestión enorme en las ciencias biomédicas", dice Núñez.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.