Ein An-Aus-Schalter für die Gen-Editierung
Neue, reversible CRISPR-Methode kann Genexpression kontrollieren, während die zugrunde liegende DNA-Sequenz unverändert bleibt
Anzeigen
In den letzten zehn Jahren hat das CRISPR-Cas9-Gen-Editiersystem die Gentechnik revolutioniert und ermöglicht es Wissenschaftlern, gezielte Veränderungen an der DNA von Organismen vorzunehmen. Während das System potenziell bei der Behandlung einer Vielzahl von Krankheiten nützlich sein könnte, beinhaltet CRISPR-Cas9-Editing das Schneiden von DNA-Strängen, was zu dauerhaften Veränderungen des genetischen Materials der Zelle führt.
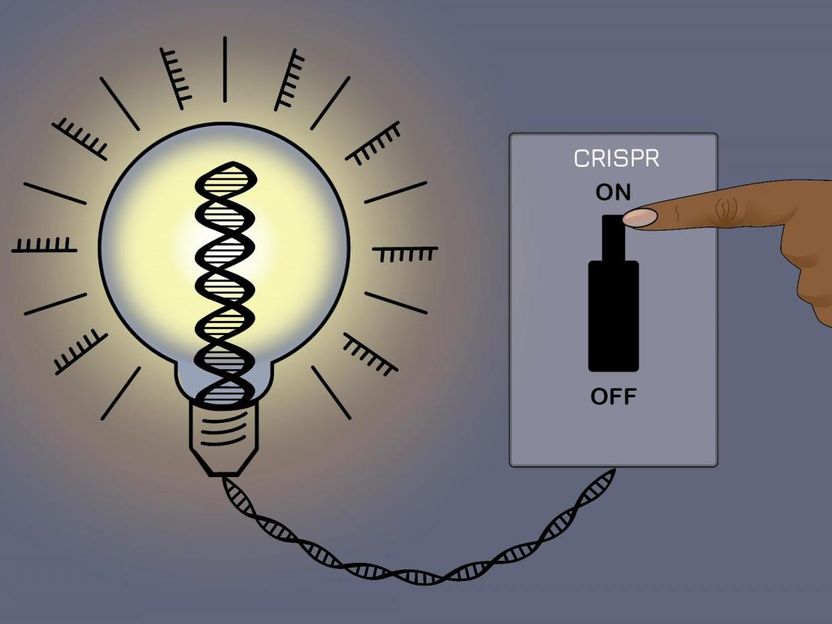
Eine neue CRISPR-Methode ermöglicht es Forschern, die meisten Gene im menschlichen Genom zum Schweigen zu bringen, ohne die zugrunde liegende DNA-Sequenz zu verändern - und die Änderungen dann rückgängig zu machen.
Jennifer Cook-Chrysos/Whitehead Institute
In einem Artikel, der am 9. April online in Cell veröffentlicht wurde, beschreiben Forscher nun eine neue Gen-Editing-Technologie namens CRISPRoff, die es Forschern ermöglicht, die Genexpression mit hoher Spezifität zu kontrollieren, während die Sequenz der DNA unverändert bleibt. Die Methode wurde von Jonathan Weissman, Mitglied des Whitehead Institute, Luke Gilbert, Assistenzprofessor an der University of California San Francisco, und James Nuñez, Postdoc im Weissman-Labor, entwickelt und ist so stabil, dass sie über Hunderte von Zellteilungen hinweg vererbt werden kann und zudem vollständig reversibel ist.
"Die große Neuigkeit ist, dass wir jetzt ein einfaches Werkzeug haben, mit dem wir die große Mehrheit der Gene zum Schweigen bringen können", sagt Weissman, der auch Professor für Biologie am MIT ist und am Howard Hughes Medical Institute forscht. "Wir können dies für mehrere Gene gleichzeitig tun, ohne DNA-Schäden, mit großer Homogenität und auf eine Weise, die wieder rückgängig gemacht werden kann. Es ist ein großartiges Werkzeug zur Kontrolle der Genexpression."
Das Projekt wurde teilweise durch einen 2017 Zuschuss von der Defense Advanced Research Projects Agency finanziert, um einen reversiblen Gen-Editor zu schaffen. "Schnell vorwärts vier Jahre [von der ursprünglichen Gewährung], und CRISPRoff endlich funktioniert, wie in einer science-fiction-Weise vorgestellt," sagt co-senior-Autor Gilbert. "Es ist aufregend zu sehen, dass es in der Praxis so gut funktioniert."
Gentechnologie 2.0
Das klassische CRISPR-Cas9-System verwendet ein DNA-schneidendes Protein namens Cas9, das in bakteriellen Immunsystemen vorkommt. Das System kann mit einer einzigen Leit-RNA auf bestimmte Gene in menschlichen Zellen ausgerichtet werden, wo die Cas9-Proteine winzige Brüche im DNA-Strang erzeugen. Dann flickt die vorhandene Reparaturmaschinerie der Zelle die Löcher.
Da diese Methoden die zugrunde liegende DNA-Sequenz verändern, sind sie dauerhaft. Außerdem bedeutet ihre Abhängigkeit von zellinternen" Reparaturmechanismen, dass es schwierig ist, das Ergebnis auf eine einzige gewünschte Veränderung zu beschränken. "So schön CRISPR-Cas9 auch ist, es überlässt die Reparatur den natürlichen zellulären Prozessen, die komplex und vielschichtig sind", sagt Weissman. "Es ist sehr schwer, die Ergebnisse zu kontrollieren."
Hier sahen die Forscher eine Chance für eine andere Art von Gen-Editor - einen, der nicht die DNA-Sequenzen selbst verändert, sondern die Art und Weise, wie sie in der Zelle gelesen werden.
Diese Art der Modifikation wird von Wissenschaftlern als "epigenetisch" bezeichnet - Gene können aufgrund chemischer Veränderungen des DNA-Strangs zum Schweigen gebracht oder aktiviert werden. Probleme mit der Epigenetik einer Zelle sind für viele menschliche Krankheiten wie das Fragile X-Syndrom und verschiedene Krebsarten verantwortlich und können über Generationen weitergegeben werden.
Epigenetisches Gen-Silencing funktioniert oft durch Methylierung - das Hinzufügen von chemischen Markierungen an bestimmten Stellen im DNA-Strang - wodurch die DNA für die RNA-Polymerase unzugänglich wird, das Enzym, das die genetische Information in der DNA-Sequenz in Boten-RNA-Transkripte abliest, die letztlich die Baupläne für Proteine sein können.
Weissman und seine Mitarbeiter hatten zuvor zwei andere epigenetische Editoren namens CRISPRi und CRISPRa entwickelt - aber beide waren mit einer Einschränkung versehen. Damit sie in Zellen funktionieren, mussten die Zellen ständig künstliche Proteine exprimieren, um die Veränderungen aufrechtzuerhalten.
"Mit dieser neuen CRISPRoff-Technologie können Sie [ein Protein kurz exprimieren], um ein Programm zu schreiben, das sich die Zelle merkt und auf unbestimmte Zeit ausführt", sagt Gilbert. "Es ändert das Spiel, so dass Sie jetzt im Grunde eine Änderung schreiben, die durch Zellteilungen weitergegeben wird - in gewisser Weise können wir lernen, eine Version 2.0 von CRISPR-Cas9 zu erstellen, die sicherer und genauso effektiv ist und auch all diese anderen Dinge tun kann."
Den Schalter bauen
Um einen epigenetischen Editor zu bauen, der die natürliche DNA-Methylierung nachahmt, schufen die Forscher eine winzige Proteinmaschine, die, gesteuert von kleinen RNAs, Methylgruppen an bestimmte Stellen des Strangs anheften kann. Diese methylierten Gene werden dann "zum Schweigen gebracht", also ausgeschaltet, daher der Name CRISPRoff.
Da die Methode die Sequenz des DNA-Strangs nicht verändert, können die Forscher den Silencing-Effekt mit Hilfe von Enzymen, die die Methylgruppen entfernen, rückgängig machen - eine Methode, die sie CRISPRon nannten.
Als sie CRISPRoff unter verschiedenen Bedingungen testeten, entdeckten die Forscher ein paar interessante Eigenschaften des neuen Systems. Zum einen konnten sie die Methode auf die große Mehrheit der Gene im menschlichen Genom ausrichten - und es funktionierte nicht nur für die Gene selbst, sondern auch für andere Bereiche der DNA, die die Genexpression kontrollieren, aber nicht für Proteine kodieren. "Das war selbst für uns ein großer Schock, weil wir dachten, dass es nur für eine Untermenge von Genen anwendbar sein würde", sagt Erstautor Nuñez.
Überraschend für die Forscher war auch, dass CRISPRoff sogar in der Lage war, Gene zum Schweigen zu bringen, die keine großen methylierten Regionen, sogenannte CpG-Inseln, hatten, von denen man bisher dachte, sie seien für jeden DNA-Methylierungsmechanismus notwendig.
"Vor dieser Arbeit dachte man, dass die 30 Prozent der Gene, die keine CpG-Insel haben, nicht durch DNA-Methylierung kontrolliert werden", sagt Gilbert. "Aber unsere Arbeit zeigt eindeutig, dass man keine CpG-Insel braucht, um Gene durch Methylierung auszuschalten. Das war für mich eine große Überraschung."
CRISPRoff in Forschung und Therapie
Um das Potenzial von CRISPRoff für praktische Anwendungen zu untersuchen, testeten die Wissenschaftler die Methode in induzierten pluripotenten Stammzellen. Das sind Zellen, die sich je nach dem Cocktail von Molekülen, dem sie ausgesetzt sind, in unzählige Zelltypen im Körper verwandeln können und somit ein leistungsfähiges Modell für die Untersuchung der Entwicklung und Funktion bestimmter Zelltypen sind.
Die Forscher wählten ein Gen aus, das sie in den Stammzellen ausschalteten, und brachten sie dann dazu, sich in Nervenzellen, sogenannte Neuronen, zu verwandeln. Als sie nach demselben Gen in den Neuronen suchten, entdeckten sie, dass es in 90 Prozent der Zellen stummgeschaltet geblieben war, was zeigt, dass die Zellen eine Erinnerung an die epigenetischen Modifikationen behalten, die durch das CRISPRoff-System vorgenommen wurden, selbst wenn sie den Zelltyp wechseln.
Sie wählten auch ein Gen aus, das als Beispiel dafür dienen sollte, wie CRISPRoff für Therapeutika eingesetzt werden könnte: das Gen, das für das Tau-Protein kodiert, das mit der Alzheimer-Krankheit in Verbindung gebracht wird. Nachdem sie die Methode in Neuronen getestet hatten, konnten sie zeigen, dass mit CRISPRoff die Tau-Expression heruntergefahren, wenn auch nicht ganz ausgeschaltet werden kann. "Was wir gezeigt haben, ist, dass dies eine praktikable Strategie ist, um Tau zum Schweigen zu bringen und zu verhindern, dass dieses Protein exprimiert wird", sagt Weissman. "Die Frage ist dann, wie man das einem Erwachsenen verabreichen kann. Und würde es wirklich ausreichen, um die Alzheimer-Krankheit zu beeinflussen? Das sind große offene Fragen, vor allem die letzte."
Selbst wenn CRISPRoff nicht zu Alzheimer-Therapien führt, gibt es viele andere Erkrankungen, bei denen es potenziell angewendet werden könnte. Und während die Verabreichung an bestimmte Gewebe eine Herausforderung für Gen-Editing-Technologien wie CRISPRoff bleibt, "haben wir gezeigt, dass man es transient als DNA oder als RNA verabreichen kann, dieselbe Technologie, die die Grundlage für den Coronavirus-Impfstoff von Moderna und BioNTech ist", sagt Weissman.
Weissman, Gilbert und ihre Mitarbeiter sind begeistert von dem Potenzial von CRISPRoff auch für die Forschung. "Da wir jetzt jeden Teil des Genoms sozusagen zum Schweigen bringen können, ist es ein großartiges Werkzeug, um die Funktion des Genoms zu erforschen", sagt Weissman.
Außerdem könnte ein zuverlässiges System zur Veränderung der Epigenetik einer Zelle den Forschern helfen, die Mechanismen zu verstehen, durch die epigenetische Modifikationen durch Zellteilungen weitergegeben werden. "Ich denke, dass unser Werkzeug es uns wirklich ermöglicht, den Mechanismus der Vererbbarkeit zu untersuchen, insbesondere die epigenetische Vererbbarkeit, die eine große Frage in den biomedizinischen Wissenschaften ist", sagt Nuñez.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.