Umfassende Kartierung der Immunzellen beim Nierenkrebs
Anzeigen
Forschende der Universität Zürich haben Millionen von Immunzellen in Tumorproben von Patienten mit Nierenzellkarzinom einzeln analysiert – und präsentieren nun erstmals einen immunologischen Atlas der Tumorumgebung. Dieser weist möglichen Weiterentwicklungen von Immuntherapien den Weg.
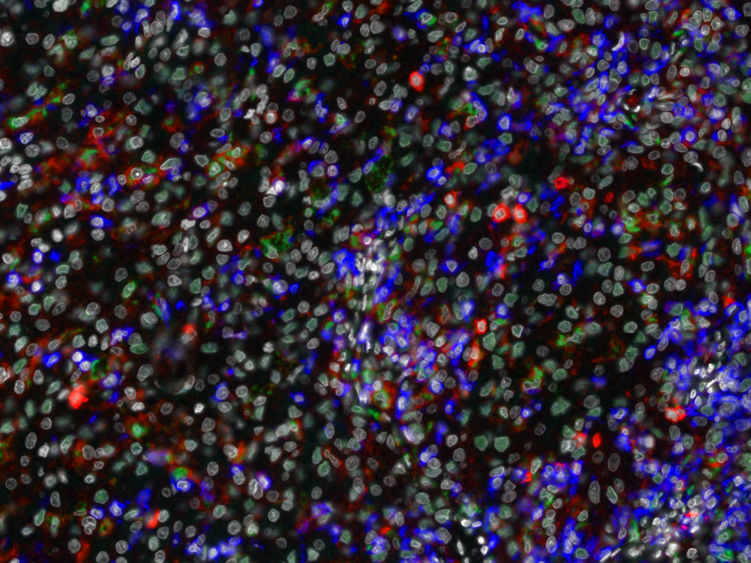
Die Fluoreszenzaufnahme zeigt verschiedene Typen von Makrophagen (grün) und T-Zellen (blau), die sich in der Mikroumgebung eines Nierentumors befinden.
Karina Silina, UZH
Das Nierenzellkarzinom ist eine der häufigsten und tödlichsten urogenitalen Krebserkrankungen. Auch wenn die Tumore behandelt werden, streuen sie schlussendlich bei etwa der Hälfte der Patienten Metastasen. 90 Prozent dieser Patienten sterben innerhalb von fünf Jahren. Die Aussichten dieser Patientengruppe haben sich dank neuartiger Immuntherapien verbessert, doch die Behandlung wirkt nur bei einer Minderheit von Patienten.
Zusammensetzung der Immunzellen beeinflusst Prognose der Patienten
Um mehr über die körpereigene Abwehr von Krebszellen – und wie sie sich stärken liesse – in Erfahrung zu bringen, haben Forschende unter der Leitung von Bernd Bodenmiller vom Institut für Molekulare Biologie der Universität Zürich insgesamt 3,5 Millionen Immunzellen in den Tumorproben von 73 Nierenzellkarzinompatienten und in den Gewebeproben von fünf gesunden Menschen einzeln analysiert. «Das bisherige Bild der Immunabwehr war korrekt, aber grob und unscharf. Mit unseren Methoden zur umfassenden Vermessung einzelner Abwehrzellen konnten wir erstmals einen immunologischen Atlas der Tumorumgebung erstellen. Damit kommen jetzt viel mehr Facetten ans Licht», sagt der Erstautor der Studie, Stéphane Chevrier.
Ob ein Tumor sich an einem bestimmten Ort im Körper entwickeln und durchsetzen kann, hängt vor allem auch mit der Antwort des körpereigenen Abwehrsystems in der unmittelbaren Umgebung des Tumors zusammen. Wie die Wissenschaftler berichten, haben sie dank dem Immunatlas neue Beziehungen zwischen den verschiedenen Abwehrzellen identifiziert. Insbesondere haben die Forschenden sogenannte Immunzellsignaturen definiert, die mit der Prognose der Patienten in Bezug stehen. Denn Art und Menge der Eiweissstrukturen auf der Oberfläche von Immunzellen spielen eine wesentliche Rolle, wie die Krankheit verläuft und wie ein Patient auf Immuntherapien anspricht. «Solche Informationen könnten helfen, besser zu verstehen, wie diese Behandlungen im Sinne der personalisierten Medizin individuell angepasst werden könnten», folgert Bernd Bodenmiller.
Unterbrechung eines zusätzlichen Signalwegs als mögliches therapeutisches Ziel
Zudem hat das Team um Bodenmiller gezeigt, dass sich gewisse therapeutisch genutzte Oberflächenmoleküle (sogenannte «Checkpoints» wie etwa PD-1 oder CTLA-4) nicht auf den Immunzellen aller Patienten nachweisen lassen. Substanzen, die diese Oberflächeneiweisse blockieren, verhindern, dass die Immunzellen bei der Krebsabwehr ausgebremst werden. Diese Resultate könnten erklären, wieso die neuartigen Checkpoint-Inhibitoren nur bei einer Minderheit der Patienten wirken. Mit komplexen bioinformatischen Analysen ist die Gruppe zudem auf ein weiteres mögliches Zielmolekül namens CD38 gestossen, das auf der Oberfläche von ausgebremsten oder erschöpften T-Zellen zu finden ist. Ob mit der Unterbrechung dieses zusätzlichen CD38-Signalwegs in Zukunft mehr Nierenkrebspatienten geholfen werden kann, muss sich in einem nächsten Schritt noch weisen. Bodenmillers Forschungspartner in Australien haben schon begonnen, dementsprechende klinische Versuche zu planen.
Originalveröffentlichung
Stéphane Chevrier, Jacob Harrison Levine, Vito Riccardo Tomaso Zanotelli, Karina Silina, Daniel Schulz, Marina Bacac, Carola Hermine Ries, Laurie Ailles, Michael Alexander Spencer. Jewett, Holger Moch, Maries van den Broek, Christian Beisel, Michael Beda Stadler, Craig Gedye, Bernhard Reis, Dana Pe’er, and Bernd Bodenmiller; "An immune atlas of clear cell renal cell carcinoma"; Cell; 4 May 2017.