Molekulare Ansätze verbessern Wirkung der Strahlentherapie bei Tumoren
Anzeigen
Zwei Forscherinnen der TU München wollen den Heilungserfolg von Tumorerkrankungen nach Strahlentherapie verbessern. Dabei setzen sie auf neue molekulare Behandlungsansätze, welche die Strahlenempfindlichkeit speziell von Krebszellen erhöhen und die körpereigene Immunantwort gegen den Tumor stimulieren. Im Fokus der Untersuchung stehen sogenannte Hitzeschock- oder Stressproteine (HSPs). HSPs werden von Tumorzellen in großen Mengen gebildet. Im Zellinneren unterstützen HSPs die Faltung von Eiweißen, die für das Wachstum und Überleben von Tumorzellen essentiell und so mitverantwortlich für die Resistenz der Tumorzellen gegenüber Strahlentherapie sind.
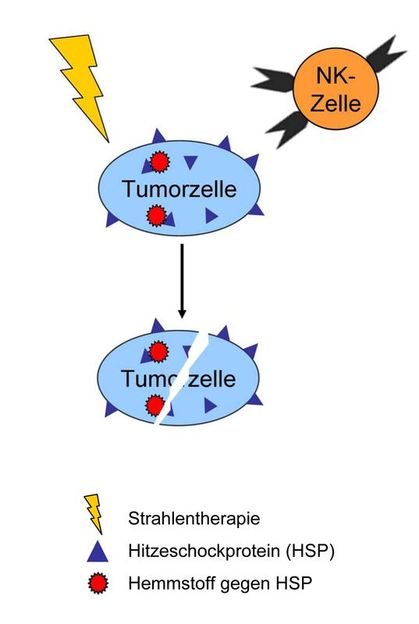
Beim Kräftemessen zwischen Krebstherapie und Tumor spielen die sogenannten Hitzeschockproteine (HSPs) eine ambivalente Rolle: Im Inneren der Tumorzelle unterstützen sie das Überleben der Tumorzelle, indem sie diese gegen Bestrahlung unempfindlich machen. An der Zelloberfläche dagegen weisen die HSPs die Tumorzelle – quasi wie ein Etikett – als entartet aus. Sie spielen damit dem Immunsystem in die Karten, das die Krebszelle daraufhin mit NK-Zellen attackiert. Die schematische Abbildung zeigt eine ideale Therapieoption: die Abtötung der Tumorzellen durch die Interaktion von Strahlentherapie, Hemmstoffen gegen HSPs und NK-Zellen.
Dr. Daniela Schilling
In Vorarbeiten konnten Dr. Daniela Schilling und Prof. Gabriele Multhoff, Leiterin der Klinischen Kooperationsgruppe „Innate Immunity in Tumor Biology“ am Helmholtz Zentrum München und am Klinikum rechts der Isar (TU München) zeigen, dass die Hemmung des Hitzeschockproteins Hsp90 im Zellinneren die Wirkung der Strahlentherapie verbessert. Ein Nachteil der Hsp90-Blockade besteht jedoch darin, dass im Gegenzug andere HSPs von der Tumorzelle verstärkt produziert werden. Die Wirksamkeit der Hsp90-Hemmung könnte dadurch eingeschränkt werden. Diesem Dilemma wollen die Forscherinnen entgehen, indem sie gleichzeitig verschiedene HSPs in Tumorzellen hemmen.
Die Rolle der HSPs für das Tumorwachstum scheint außerdem ambivalent zu sein: Während HSPs im Zellinneren eine Schutzfunktion als „Kindermädchen“ für Eiweiße übernehmen, die das Tumorwachstum fördern, fungieren sie auf der Oberfläche von Tumorzellen als Angriffspunkte für spezielle Immunzellen, die sogenannten Natürlichen Killer (NK)-Zellen. NK-Zellen stellen eine Unterklasse von Immunzellen dar, die Tumorzellen gezielt attackieren. Eine Strahlenbehandlung kann die Menge der HSPs auf der Oberfläche von Tumorzellen steigern. Sie werden dadurch für die NK-Zellen besser erkennbar und angreifbar.
Die Blockade der HSPs im Zellinneren könnte diesen gewünschten Effekt an der Zelloberfläche jedoch negativ beeinflussen. Auch die Wechselwirkung zwischen Tumorzellen und NK-Zellen könnte sich damit verändern. Inwieweit und in welcher Form dies geschieht, wollen Daniela Schilling und Gabriele Multhoff in ihrem Forschungsvorhaben klären.