Wie der Tuberkulose-Erreger in der Lunge überlebt
Ein vielseitiges Enzym macht Mykobakterien besonders gefährlich
Anzeigen
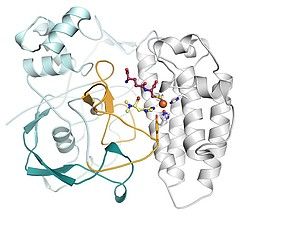
Manchmal ist es nur ein einziges Molekül, das den Unterschied zwischen einem harmlosen Keim und einem hoch gefährlichen Krankheitserreger ausmacht. Das Enzym Ag85A beispielsweise hat entscheidenden Anteil daran, dass der Tuberkulose-Erreger Mycobacterium tuberculosis weltweit einer der größten bakteriellen "Killer" ist. Es produziert den sogenannten Cord-Faktor. Dieser sitzt auf der Oberfläche des Erregers und sorgt dafür, dass der Erreger in den Fresszellen der Lunge überleben und sich so vor dem Immunsystem verstecken kann. Forscher des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) haben nun herausgefunden, dass Ag85A noch weit mehr zur Gefährlichkeit des Bakteriums beiträgt: Es stellt wichtige Speicherstoffe her, die ein jahrelanges Überleben des Erregers im Menschen ermöglichen.
Mehr als zwei Milliarden Menschen sind nach Angaben der Weltgesundheitsorganisation mit Tuberkulose infiziert. Etwa zwei Millionen Tote fordert die Krankheit jährlich. Vor allem in Afrika und Asien breiten sich viele neue gefährliche Stämme aus, die gegen die bekannten Antibiotika resistent sind. Solche Fälle sind nur sehr schwer zu behandeln. Oft kann den Patienten nicht mehr geholfen werden, da gegen viele Erregerstämme kein Medikament mehr wirkt.
Eine Vielzahl von Enzymen hilft dabei, die Zellwand des Tuberkuloserregers Mycobacterium tuberculosis aufzubauen. Ag85A gehört zu ihnen: Es verknüpft eine spezielle Fettsäure mit einem bestimmten Zucker – so entsteht der Cord-Faktor. Da Erreger ohne Cord-Faktor nicht mehr krankmachend sind, ist das Enzym Ag85A ein wichtiges Ziel in der Medikamentenforschung gegen Tuberkulose. "Ein Hemmstoff gegen dieses Enzym hat ein großes Potential für einen neuen Wirkstoff gegen Tuberkulose", sagt Matthias Stehr, Wissenschaftler in der Abteilung "Genregulierung und Differenzierung" am HZI. "Die Zellwand des Tuberkulose-Erregers ist eine der kompliziertesten und dicksten aller bekannten Bakterien", so Stehr. Dies verhindere sehr effektiv, dass zum Beispiel Antibiotika dem Bakterium schaden könnten. Alternative Medikamente würden dringend gesucht.
Um das Enzym näher zu charakterisieren, brachten die Forscher die genetische Information in eine harmlose Variante der Mykobakterien ein. "Die Zellwand der Bakterien wurde wie erwartet dicker", erklärt Matthias Stehr. Die eigentliche Überraschung war jedoch: Die Bakterien bildeten zusätzlich Fettspeicher. "Wir vermuten, dass Ag85A daran beteiligt ist, diese Reserven aufzubauen." Wenn die Wissenschaftler dagegen ein verändertes Ag85A verwendeten, das keine Fettsäuren mehr binden kann, unterblieb auch die Bildung der Fettspeicher.
Neu gefundene Mechanismen zeigen, dass das Enzym eine Reihe von Substanzen binden kann, von denen nicht bekannt war, dass sie mit Ag85A reagieren. "Wir müssen nun untersuchen, welche Reaktion genau in den Bakterien abläuft", sagt Stehr. "Dieses Wissen kann neue Ansätze für Medikamente, Therapien und Impfstoffe eröffnen – oder die Entwicklung neuer Schnelltests ermöglichen. Substanzen, die mit Ag85A reagieren, könnten beispielsweise künftig als Basis für neue Hemmstoffe gegen Tuberkulose verwendet werden. "