Ein Powerpärchen macht Krebszellen mobil
Anzeigen
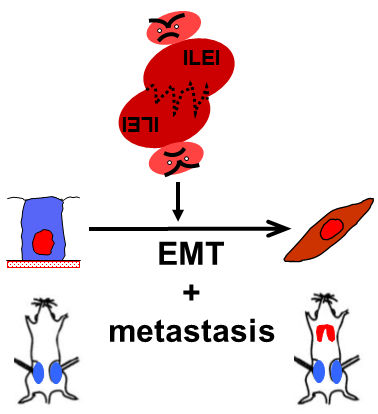
Das Protein ILEI verwandelt sesshafte in mobile Zellen und gilt daher als wichtiger Signalgeber für die Metastasierung von Krebszellen. Es ist Mitglied einer ganzen Protein-Familie, die nur unzureichend erforscht ist. Krebsforscherin Agnes Csiszar hat unterstützt vom Wissenschaftsfonds FWF gezeigt, dass ein ILEI alleine nichts ausrichtet. Um aktiv zu werden, müssen sich zwei idente Proteine aneinander binden.
Once ILEI has been released by the cells, the individual proteins (monomers) look for an identical partner molecule in the extracellular space and form active power pairs (dimers).
Agnes Csiszar
Wenn Agnes Csiszar von der FAM3 Protein-Familie erzählt, fühlt man sich an einen Mafiaclan erinnert, dessen Mitglieder an verschiedenen Krankheitsbildern beteiligt, aber schwer dingfest zu machen sind. Das Protein FAM3C oder ILEI gilt als wichtiger Signalgeber für die Metastasierung von Krebszellen. In einem Prozess namens EMT (epithelial-to-mesenchymal transition) ist ILEI daran beteiligt, sesshafte, aneinandergeknüpfte Zellen von soliden Tumoren zu mobilisieren, wodurch der Krebs im Körper streuen kann. Andere Mitglieder von FAM3 (A, B und D) gelten als potenziell wichtige Moleküle zur Behandlung verbreiteter Erkrankungen.
Vom Proteinpäckchen zum Botenstoff
Das Substanzgefüge in und um eine Zelle wird nicht mit einem Knopfdruck angekurbelt. Immer sind es sorgfältig regulierte Signalketten und molekulare Kaskaden, die Prozesse in Gang setzen. Agnes Csiszar hat sich am Wiener Forschungsinstitut für Molekulare Pathologie (IMP) einige Jahre mit ILEI beschäftigt und die biochemischen Bestandteile des Protein-Steckbriefs zusammengetragen. Man wusste bereits, dass in nicht-metastasierenden Krebszellen das FAM3C-Protein an einem Ort gebündelt bleibt. Das konnte durch gezielte histochemische Einfärbung gezeigt werden. In metastasierenden Krebszellen ist ILEI hingegen diffus über die ganze Zelle verteilt. Die Forscherin hat nachgewiesen, dass metastasierende Krebszellen viel mehr ILEI ausschütten und die Menge mit der Metastasierung korreliert. Es blieb aber unbekannt, wie das ausgeschüttete ILEI weiter reguliert und in eine aktive Form umgewandelt wird. In ihrem Einzelforschungsprojekt „Entstehung und Rolle von ILEI-Dimeren in der Krebsprogression“ hat Agnes Csiszar nun am Institut für Krebsforschung der Medizinischen Universität Wien, unterstützt vom Wissenschaftsfonds FWF, jene Signalkette ein Stück weiter aufgedröselt, die letztlich Metastasierung vorantreibt.
Ein Date im extrazellulären Raum
Wenn ILEI von den Zellen einmal ausgeschüttet wurde, suchen sich die einzelnen Proteine (Monomere) im extrazellulären Raum ein identes Partnermolekül und bilden aktive Powerpärchen (Dimere): „In den beiden ILEI-Monomeren werden jene chemische Verbindungen gelöst, die das Molekül in Form halten und an das baugleiche Pendant wieder angeknüpft. Es braucht diese Bindung, um ILEI zu aktivieren und Krebs voranzutreiben“, erklärt Agnes Csiszar.
Funktionelle Ergebnisse gewann die Molekularbiologin aus Zellkulturen, im Mausmodell und durch den Einsatz normaler und für Dimerbildung deaktivierter ILEI-Moleküle. Diese Daten wurden in Kooperation mit Astra Zeneca durch Kristallstrukturuntersuchungen der Moleküle untermauert. Der Pharmakonzern hatte zuvor über FAM3B publiziert, das als vielversprechender Angriffspunkt für Diabetes-Medikamente gilt. Agnes Csiszar kontaktierte die Forschungsabteilung und gemeinsam wurde sichtbar gemacht, wie die zwei ILEI-Monomere aneinander binden können.
In Folgeprojekten untersucht Agnes Csiszar nun, welche Faktoren die Bildung solcher Powerpärchen (Dimere) beschleunigen und welchen Rezeptor in der Signalkette das ILEI-Paar aktiviert. Als therapeutische Ansatzpunkte wären sowohl die hochaktiven Signalmoleküle geeignet, als auch die Rezeptoren. Dazu müssen Letztere aber noch identifiziert werden.
Originalveröffentlichung
Kral M, Klimek C, Kutay B, Timelthaler G, Lendl T, Neuditschko B, Gerner C, Sibilia M, Csiszar A.; "Covalent dimerization of interleukin-like epithelial-to-mesenchymal transition (EMT) inducer (ILEI) facilitates EMT, invasion, and late aspects of metastasis"; FEBS Journal, 2017.
Jansson AM, Csiszar A, Maier J, Nyström AC, Ax E, Johansson P, Schiavone LH; "The interleukin-like epithelial-mesenchymal transition inducer ILEI exhibits a non-interleukin-like fold and is active as a domain-swapped dimer"; Journal of Biological Chemistry; 2017.
Csiszar A, Kutay B, Wirth S, Schmidt U, Macho-Maschler S, Schreiber M, Alacakaptan M, Vogel GF, Aumayr K, Huber LA, Beug H; "Interleukin-like epithelial-to-mesenchymal transition inducer activity is controlled by proteolytic processing and plasminogen-urokinase plasminogen activator receptor system-regulated secretion during breast cancer progression"; Breast Cancer Research; 2014.























































