Durchbruch: Strukturanalyse des Proteins FAT10 gelungen
Grundlagenforschung zu möglichem Krebstherapeutikum
Anzeigen
FAT10 ist ein kleines Protein mit großer Wirkung. Bindet es an ein sogenanntes Zielprotein, ist das ein Signal, dass das Zielprotein abgebaut wird. FAT10 stellt ein Markierungssystem dar, das im Vergleich allerdings nicht sehr effizient arbeitet. Im Gegensatz zur biologischen Konkurrenzeinrichtung Ubiquitin, das recycelt wird, geht es gemeinsam mit seinem Zielprotein unter. Im Vergleich zu Ubiquitin stellt FAT10 somit auf den ersten Blick eine natürliche Verschwendung dar.
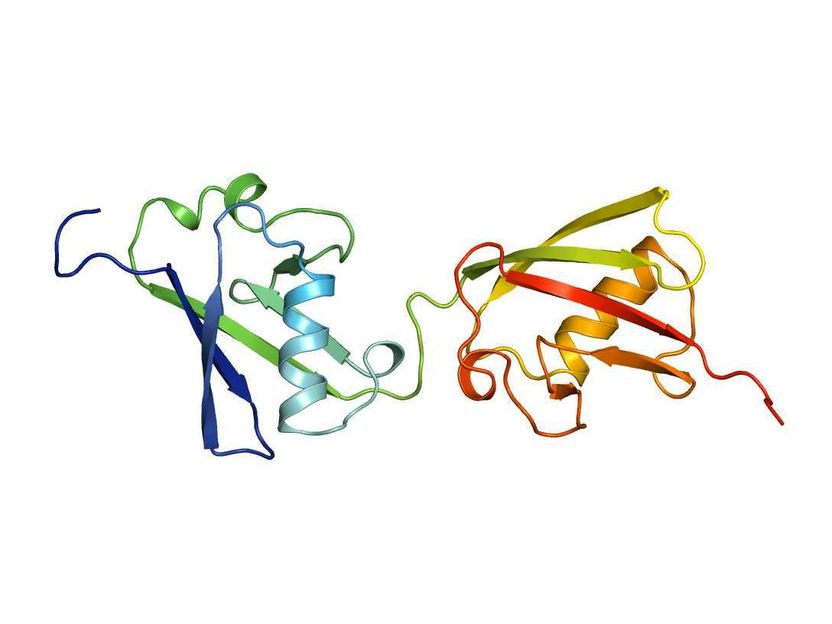
FAT10-Struktur
Marcus Groettrup
Warum gibt es dieses FAT10-System, das viel ineffizienter scheint als das Ubiquitin-System? Prof. Dr. Marcus Groettrup, Leiter der Arbeitsgruppe Immunologie an der Universität Konstanz, forscht mit seinem Team seit vielen Jahren zu FAT10. Nun ist ein Durchbruch gelungen, der es ermöglicht, die Hochauflösungsstruktur von FAT10 zu bestimmen. Voraussetzung dafür war eine andere Leistung. In Zusammenarbeit mit Dr. Annette Aichem vom Biotechnologie Institut Thurgau (BITg), mit der Konstanzer Chemikerin Prof. Dr. Christine Peter und der Strukturbiologin Dr. Silke Wiesner von der Universität Regensburg konnte eine molekulare Technik entwickelt werden, mit der stabiles und hochkonzentriertes FAT10 von hohem Reinheitsgrad herstellbar wird. In der Folge sind die Wissenschaftler in der Lage, FAT10 einer Röntgenstruktur- und Kernspinresonanzanalyse zu unterziehen.
„Wir sind beim Ubiquitin-ähnlichen FAT10 auf einen völlig anderen Mechanismus gestoßen als bei Ubiquitin, der für das Ubiquitin-Gebiet insgesamt strukturell sehr interessant ist“, sagt Marcus Groettrup. Im Gegensatz zu Ubiquitin mit einer Domäne besitzt FAT10 zwei Domänen. Das sind Faltungseinheiten, durch die die Proteine ihre Funktion ausüben und die im Fall von FAT10 durch ein Verbindungsstück gekoppelt sind. Aufgefallen ist dem Team, dass die beiden Domänen flexibel gegeneinander sind und ihre Faltung viel schwächer ist als bei Ubiquitin. Schließlich verfügt FAT10 über einen kurzen Fortsatz, der unstrukturiert ist.
Wie Experimente zeigen, haben die lockere Faltung und der unstrukturierte Fortsatz des FAT10-Proteinsystems wichtige Regulierungsaufgaben, die den Abbau des Zielmoleküls tatsächlich vereinfachen. So müssen nicht, wie beim Ubiquitin-System, vor dem „Schreddern“ des Zielproteins komplizierte Prozesse zur Lockerung der Faltung vorgeschaltet sein, damit das Enzym 26S-Proteasom, das den Abbau tatsächlich durchführt, zugreifen kann. Die lockere Faltung der FAT10-Domänen macht dies überflüssig. Das Enzym greift sich das unstrukturierte Stück, kann die beiden flexiblen und schwach gefalteten Domänen leicht auseinanderziehen und in der Folge das daran hängende Zielprotein ebenfalls auseinanderziehen und so abbauen.
Bekannt war bereits zuvor, dass Ubiquitin und FAT10 völlig unterschiedliche Bindungseigenschaften besitzen. Das ist umso erstaunlicher, da die Domänen beider Proteine von der Grundstruktur her gleich gefaltet sind. Dank der Ergebnisse des Forschungsteams um den Konstanzer Immunologen weiß man warum: Die Oberflächenladungen von Fat10 und Ubiquitin sind völlig unterschiedlich, und die bestimmen, an welche Proteine angedockt wird. Entsprechend sind auch die Zielproteine beider Markierungssysteme andere. FAT10 kommt vorwiegend in entzündlichen Geweben vor. „Ohne Entzündung ist es praktisch überhaupt nicht vorhanden“, sagt Marcus Groettrup. Dass beim Abbau von Proteinen in diesem Kontext auch das Markierungssystem mit zerstört wird, sieht der Biologe als Vorteil. Seine Hypothese lautet: Die Natur setzt hier auf Irreversibilität, damit der Prozess des Proteinabbaus nicht rückgängig gemacht werden kann.
Noch etwas ist bei FAT10 sehr auffällig. Marcus Groettrup: „Es kommt in dreizehn verschiedenen Krebsarten in erhöhtem Maß vor. Daraus lässt sich schließen, dass FAT10 für die Krebszellen von Vorteil sein muss, für ihr Überleben und ihr Wachstum.“ Dockt FAT10 beispielsweise an Eiweiße an, die das Tumorwachstum unterdrücken, werden sie abgebaut und die Tumorzelle kann besser wachsen. Für diesen Fall könnte man sich ein Krebstherapeutikum vorstellen, das das Enzym hemmt, das FAT10 mit dem Protein verknüpft. „Was die Anwendung betrifft, bestehen da tatsächlich Hoffnungen“, so Marcus Groettrup abschließend.
Originalveröffentlichung
Annette Aichem, Samira Anders, Nicola Catone, Philip Rößler, Sophie Stotz, Andrej Berg, Ricarda Schwab, Sophia Scheuermann, Johanna Bialas, Mira C. Schütz-Stoffregen, Gunter Schmidtke, Christine Peter, Marcus Groettrup & Silke Wiesner; "The structure of the ubiquitin-like modifier FAT10 reveals an alternative targeting mechanism for proteasomal degradation"; Nature Communications; Volume 9, Article number: 3321 (2018)