Dois-je rester ou dois-je partir ? La double stratégie du germe hospitalier
Pourquoi P. aeruginosa réussit-elle à coloniser les surfaces ?
Les infections font partie des complications les plus fréquentes lors d'un séjour à l'hôpital. Des chercheurs de l'université de Bâle viennent de découvrir pourquoi l'un des pathogènes nosocomiaux les plus dangereux est si difficile à combattre. Il suit une double stratégie, certaines bactéries colonisant la surface des tissus tandis que d'autres se propagent dans l'organisme. L'étude fournit des informations importantes sur le processus d'infection et ouvre la voie à de nouvelles méthodes de traitement des infections.
En Suisse, il n'est pas rare qu'un patient développe une infection lors d'un séjour à l'hôpital. L'une des raisons en est le manque d'hygiène, comme l'a montré récemment une étude de l'Institut suisse des produits thérapeutiques (Swissmedic). Chaque année, environ 6 000 patients meurent d'une infection nosocomiale. L'un des agents pathogènes les plus préoccupants est le Pseudomonas aeruginosa. Cette bactérie résistante colonise la peau et les surfaces muqueuses et peut provoquer une pneumonie potentiellement mortelle, en particulier chez les patients immunodéprimés.
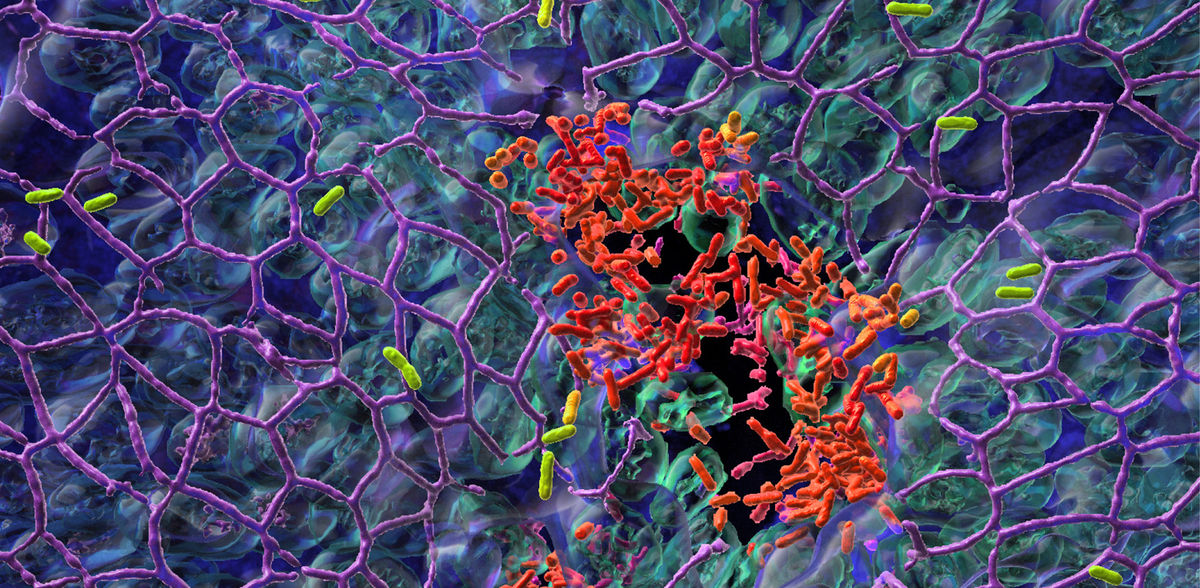
L'équipe de recherche du professeur Urs Jenal du Biozentrum de l'Université de Bâle a découvert pourquoi P. aeruginosa réussit à coloniser les surfaces : elle pratique une division du travail. Tandis qu'une fraction de la population bactérienne adhère à la surface de la muqueuse et forme un biofilm, l'autre sous-population se répand dans des sites tissulaires éloignés. Grâce à ce processus de "partage des tâches", les agents pathogènes réussissent mieux à coloniser la surface. Protégés dans un biofilm, ils peuvent même résister aux traitements antibiotiques.
Division du travail : bactéries mobiles et sessiles
Dans leur étude, récemment publiée dans "Nature Microbiology", les scientifiques font état d'un commutateur génétique stochastique responsable de la division du travail et donc du mode de vie des bactéries - mobiles ou sessiles. Après la colonisation initiale de la surface, les agents pathogènes ne se divisent pas simplement au hasard, mais forment plutôt deux sous-populations fonctionnellement distinctes.
Ce comportement est régulé par différents niveaux de la molécule de signalisation bactérienne c-di-GMP. Les bactéries ayant des niveaux élevés de c-di-GMP se fixent aux surfaces et forment un biofilm robuste, tandis que les bactéries ayant des niveaux faibles sont mobiles et se dispersent dans le tissu environnant pour coloniser d'autres parties du tissu de l'hôte. La concentration de c-di-GMP et, par conséquent, le comportement des bactéries sont régulés par ce commutateur stochastique.
"Mécanisme "Stick and run
"La stratégie de division du travail permet aux bactéries de répondre rapidement à différentes conditions de stress, car à tout moment, une fraction des cellules est adaptée de manière optimale pour survivre", explique le Dr Christina Manner, premier auteur de l'étude. Les bactéries des communautés de biofilms, par exemple, sont protégées des attaques des cellules immunitaires, tandis que la fraction des bactéries mobiles dispersées peut conquérir de nouveaux territoires. Cette répartition des tâches est également connue sous le nom de mécanisme "stick and run".
"Nous comprenons maintenant mieux comment Pseudomonas aeruginosa parvient à se propager et à prospérer sur la muqueuse pulmonaire", explique Urs Jenal, chef de projet. "En identifiant le commutateur génétique, nous avons découvert le talon d'Achille de l'agent pathogène". L'étude ne fournit pas seulement des informations précieuses sur le processus d'infection, mais révèle également de nouvelles options thérapeutiques pour lutter contre les infections dues à ce dangereux pathogène nosocomial.
"Nous avons également pu montrer que le Disperazol, un composé anti-biofilm récemment découvert, cible le même mécanisme et fait basculer l'interrupteur en faveur des cellules mobiles de Pseudomonas, ce qui entraîne la dispersion du biofilm", ajoute M. Jenal. "Il s'agit d'une avancée majeure, car de tels agents ouvrent de nouvelles voies pour éradiquer les infections à biofilm difficiles à traiter."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Christina Manner, Raphael Dias Teixeira, Dibya Saha, Andreas Kaczmarczyk, Raphaela Zemp, Fabian Wyss, Tina Jaeger, Benoit-Joseph Laventie, Sebastien Boyer, Jacob G. Malone, Katrine Qvortrup, Jens Bo Andersen, Michael Givskov, Tim Tolker-Nielsen, Sebastian Hiller, Knut Drescher & Urs Jenal; A genetic switch controls Pseudomonas aeruginosa surface colonization; Nature Microbiology; 2023