¿Me quedo o me voy? La doble estrategia del germen hospitalario
Por qué P. aeruginosa consigue colonizar las superficies
Las infecciones figuran entre las complicaciones más frecuentes durante una estancia hospitalaria. Investigadores de la Universidad de Basilea han descubierto por qué uno de los patógenos nosocomiales más peligrosos es tan difícil de combatir. Sigue una estrategia dual: algunas bacterias colonizan la superficie de los tejidos, mientras que otras se propagan por el organismo. El estudio aporta importantes conocimientos sobre el proceso de infección y abre nuevas vías para tratar las infecciones.
En Suiza, no es infrecuente que un paciente desarrolle una infección durante su estancia en el hospital. Uno de los motivos es la falta de higiene, como ha demostrado recientemente un estudio de la Agencia Suiza de Productos Terapéuticos, Swissmedic. Cada año mueren unos 6.000 pacientes por infecciones nosocomiales. Uno de los patógenos más preocupantes es la Pseudomonas aeruginosa. Esta bacteria resistente coloniza la piel y las superficies mucosas y puede causar neumonías potencialmente mortales, sobre todo en pacientes inmunodeprimidos.
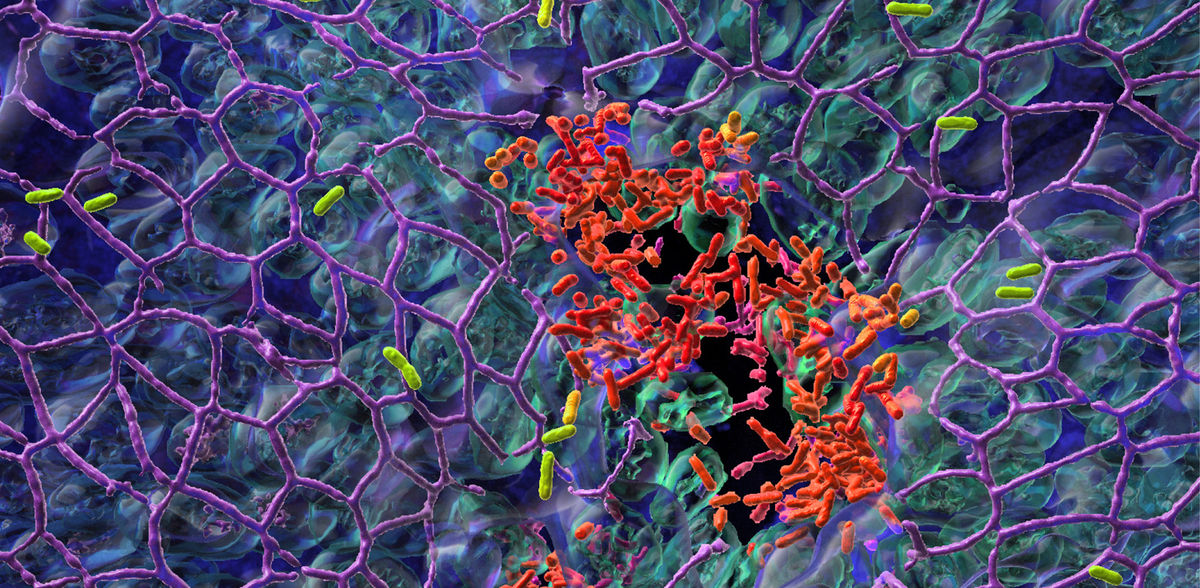
El equipo de investigación del profesor Urs Jenal, del Biozentrum de la Universidad de Basilea, ha descubierto ahora por qué P. aeruginosa consigue colonizar las superficies: practica una división del trabajo. Mientras una fracción de la población bacteriana se adhiere a la superficie de la mucosa y forma una biopelícula, la otra subpoblación se propaga a sitios tisulares distantes. Mediante este proceso de "reparto del trabajo", los patógenos aumentan su éxito de colonización de la superficie. Protegidos en una biopelícula, pueden incluso resistir los tratamientos antibióticos.
División del trabajo: bacterias móviles y sésiles
En su estudio, publicado recientemente en "Nature Microbiology", los científicos informan de un cambio genético estocástico responsable de la división del trabajo y, por tanto, del estilo de vida de las bacterias: móviles o sésiles. Tras la colonización inicial de la superficie, los patógenos no se dividen simplemente al azar, sino que forman dos subpoblaciones funcionalmente distintas.
Este comportamiento está regulado por diferentes niveles de la molécula de señalización bacteriana c-di-GMP. Las bacterias con altos niveles de c-di-GMP se adhieren a las superficies y forman una biopelícula robusta, mientras que las bacterias con niveles bajos son móviles y se dispersan por el tejido circundante para colonizar otras partes del tejido del huésped. La concentración de c-di-GMP y, en consecuencia, el comportamiento de las bacterias está regulado por este interruptor estocástico.
"Mecanismo de "pega y corre
"La estrategia de división del trabajo permite a las bacterias responder rápidamente a diferentes condiciones de estrés, porque en un momento dado, una fracción de las células está óptimamente adaptada para sobrevivir", explica la Dra. Christina Manner, primera autora del estudio. Las bacterias de las comunidades de biopelículas, por ejemplo, están protegidas de los ataques de las células inmunitarias, mientras que la fracción de bacterias móviles dispersivas puede conquistar nuevos terrenos. Esta división del trabajo también se conoce como mecanismo de "pega y corre".
"Ahora comprendemos mejor cómo Pseudomonas aeruginosa consigue propagarse y prosperar en la mucosa pulmonar", explica Urs Jenal, director del proyecto. "Al identificar el interruptor genético, hemos localizado el talón de Aquiles del patógeno". El estudio no sólo aporta información valiosa sobre el proceso de infección, sino que también revela nuevas opciones terapéuticas para controlar las infecciones por este peligroso patógeno nosocomial.
"También hemos podido demostrar que el compuesto antibiopelícula Disperazol, descubierto recientemente, se dirige al mismo mecanismo y cambia el interruptor a favor de las células móviles de Pseudomonas, lo que conduce a la dispersión de la biopelícula", añade Jenal. "Se trata de un gran paso adelante, ya que este tipo de agentes abren nuevas vías para erradicar las infecciones por biopelículas difíciles de tratar".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Christina Manner, Raphael Dias Teixeira, Dibya Saha, Andreas Kaczmarczyk, Raphaela Zemp, Fabian Wyss, Tina Jaeger, Benoit-Joseph Laventie, Sebastien Boyer, Jacob G. Malone, Katrine Qvortrup, Jens Bo Andersen, Michael Givskov, Tim Tolker-Nielsen, Sebastian Hiller, Knut Drescher & Urs Jenal; A genetic switch controls Pseudomonas aeruginosa surface colonization; Nature Microbiology; 2023