La química se une a la biología: control de membranas celulares artificiales mediante catálisis
Los investigadores desarrollan una plataforma artificial basada en metaloenzimas que permite controlar de forma programable el comportamiento de las membranas artificiales
Gracias a la química catalítica, investigadores del Instituto de Ciencias de Tokio han logrado controlar dinámicamente membranas artificiales, lo que les permite comportarse como si tuvieran vida. Empleando una metaloenzima artificial que lleva a cabo una reacción de metátesis de cierre de anillo, el equipo indujo la desaparición de dominios separados por fases, así como la división de membranas en membranas artificiales, imitando el comportamiento dinámico de las membranas biológicas naturales. Esta investigación transformadora marca un hito en las tecnologías de células sintéticas, allanando el camino para avances terapéuticos innovadores.
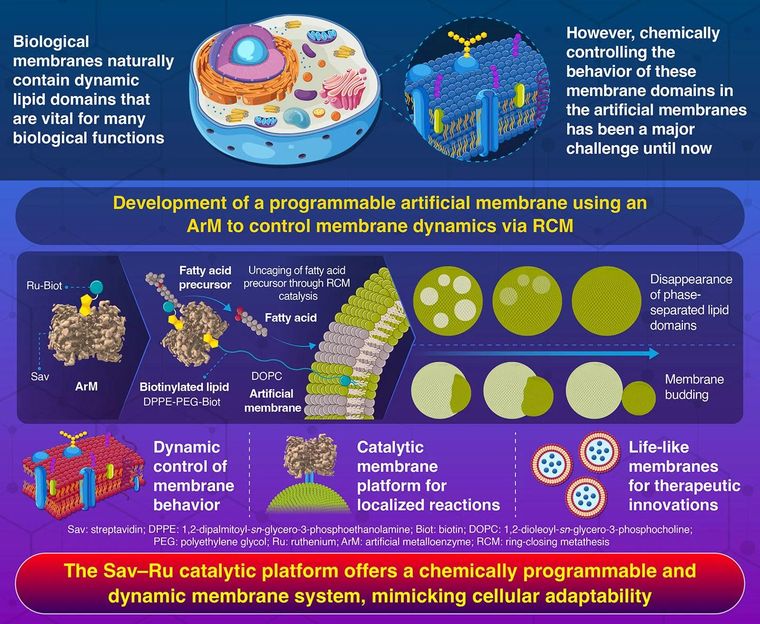
Membranas celulares artificiales programables controladas por una reacción química catalítica
Las membranas biológicas son estructuras fundamentales que forman los límites de todas las células vivas y controlan la forma en que éstas se comunican, crecen y responden a su entorno. Estas membranas están compuestas por distintas moléculas, como lípidos y proteínas, que se organizan formando una capa de membrana. En determinadas circunstancias, las moléculas se agrupan en regiones funcionales locales que regulan procesos biológicos específicos. Estas regiones agrupadas se conocen como dominios separados por fases y son distintas de la membrana circundante.
Entender y reproducir los comportamientos dinámicos de estas regiones ha fascinado durante mucho tiempo a los científicos que pretenden construir células artificiales que se comporten como células naturales. Sin embargo, dado que la mayoría de los modelos de membranas artificiales permanecen estáticos, reproducir estas propiedades adaptativas de las membranas biológicas ha seguido siendo un gran reto hasta ahora. Para hacer frente a este reto, investigadores del Instituto de Ciencias de Tokio (Science Tokyo), Japón, y de la Universidad de Basilea, Suiza, desarrollaron conjuntamente una nueva estrategia química para controlar el comportamiento de las membranas celulares artificiales.
El estudio fue dirigido por el profesor Kazushi Kinbara y el estudiante de doctorado Rei Hamaguchi, de la Escuela de Ciencias de la Vida y Tecnología de Science Tokyo (Japón), en colaboración con el profesor Thomas R. Ward, de la Universidad de Basilea (Suiza). Los resultados se publicaron en Internet el 15 de octubre de 2025 y en el volumen 147, número 43, de la revista Journal of the American Chemical Society el 29 de octubre de 2025.
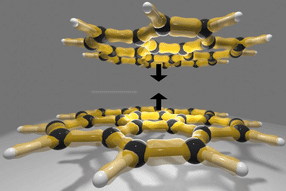
Para dar vida a las membranas, los investigadores construyeron primero unas diminutas estructuras artificiales similares a células llamadas vesículas lipídicas. A continuación, construyeron un catalizador híbrido conocido como metaloenzima artificial (ArM), una combinación de una proteína biológica, la estreptavidina (Sav), y un catalizador metálico sintético (complejo metálico de rutenio) con una fracción de biotina (vitamina B7). Esta enzima actúa como un catalizador en la membrana, llevando a cabo una reacción química crítica conocida como metátesis de cierre de anillo (RCM).
Para fijar el catalizador ArM a la superficie de la membrana lipídica, el equipo también incorporó a la membrana un tipo especial de lípido marcado con biotina, que actuó como ancla para el catalizador.
"Cuando es activado por precursores de ácidos grasos, el sistema ArM libera ácidos grasos libres a través de RCM", explica Kinbara. "Estos ácidos grasos se deslizan en la membrana, alterando sutilmente su estructura e impulsando el comportamiento dinámico de la membrana".
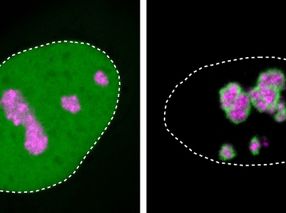
Las simulaciones moleculares revelaron mecanismos clave subyacentes a estas transformaciones. Los precursores de ácidos grasos inactivos y enjaulados fueron activados primero por el catalizador ArM mediante la reacción RCM. Esta reacción desenjaula los precursores de ácidos grasos enjaulados, liberando ácidos grasos libres cerca de la membrana. Los ácidos grasos liberados se insertan de forma natural en la superficie de la membrana, modificando su rigidez y curvatura, lo que a su vez provoca transformaciones visibles como la desaparición de los dominios separados por fases y la división de la membrana.
"Es un poco como dar a una membrana sintética la capacidad de respirar y responder", dice Kinbara. "Controlando una reacción química en la superficie de la membrana, podemos hacer que se reorganice, de forma muy parecida a como lo hace una célula viva".
Este descubrimiento supone el primer intento de programar químicamente el comportamiento físico de membranas artificiales y sienta las bases para la creación de materiales con apariencia de vida capaces de percibir y responder a su entorno. No sólo supone un avance en biología sintética, sino que también introduce un modelo para crear membranas artificiales programables que podrían inspirar futuras innovaciones terapéuticas, tendiendo un puente entre la química y la vida.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.