Une protéine soucieuse de la qualité
Cette découverte pourrait déboucher sur de nouvelles approches thérapeutiques pour la maladie d'Alzheimer et d'autres maladies liées au mauvais repliement des protéines.
Des chercheurs ont identifié une nouvelle fonction d'une enzyme bien connue : le complexe signal peptidase est responsable du contrôle de la qualité des protéines membranaires. La découverte de cette nouvelle fonction d'une enzyme clé en biologie cellulaire a été publiée dans "Science" et pourrait conduire à de nouvelles approches thérapeutiques pour la maladie d'Alzheimer et d'autres maladies liées au mauvais repliement des protéines.
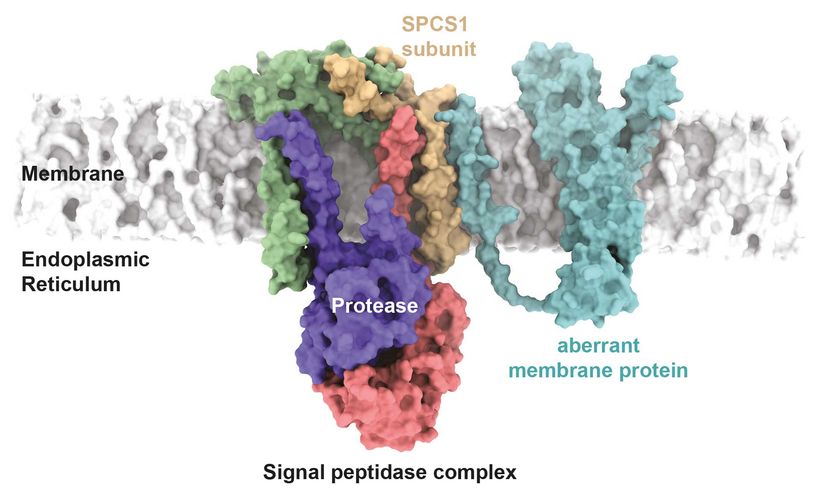
Modèle hypothétique de reconnaissance d'une protéine membranaire mutante par le complexe signal peptidase. Un mutant de Cx32 associé à une maladie interagit dans le modèle avec la sous-unité SPCS1 du complexe signal peptidase.
Manuel Hitzenberger
Une équipe interdisciplinaire de scientifiques de Cologne, Heidelberg et Munich a découvert une nouvelle fonction d'une enzyme bien connue : le complexe signal peptidase du réticulum endoplasmique clive les protéines membranaires défectueuses pour amorcer leur dégradation. Dans nos cellules, le réticulum endoplasmique est responsable de la production et du contrôle des protéines qui sont sécrétées par la cellule. Le complexe signal peptidase coupe ces chaînes polypeptidiques pour éliminer les peptides de signalisation qui permettent aux protéines d'atteindre le réticulum endoplasmique, afin que les protéines matures puissent remplir leurs fonctions spécifiques. Une équipe de recherche dirigée par Matthias Feige, professeur de biochimie des protéines cellulaires à l'Université technique de Munich (TUM), et Marius Lemberg, professeur de biochimie à l'Université de Cologne, a maintenant découvert que le complexe signal peptidase a une fonction jusqu'ici inconnue dans un autre processus clé de la biologie cellulaire : le contrôle de la qualité des protéines membranaires. Leurs résultats ont été publiés dans la revue Science sous le titre "The Human Signal Peptidase Complex Acts as a Quality Control Enzyme for Membrane Proteins".
Chaque cellule est entourée d'une bicouche lipidique, qui protège l'intérieur de la cellule, mais exige également le transport régulé de molécules et de signaux à travers cette couche isolante pour permettre une pléthore de fonctions cellulaires. Les protéines membranaires sont intégrées à cette bicouche lipidique et remplissent ces fonctions. Elles sont essentielles à la survie des cellules et constituent les cibles médicamenteuses les plus importantes. Pour fonctionner correctement, les protéines membranaires doivent adopter une structure tridimensionnelle bien définie au niveau atomique. Les défaillances de ce processus peuvent entraîner des protéines défectueuses, ce qui donne lieu à de nombreuses maladies, notamment le cancer ainsi que les troubles métaboliques et neurodégénératifs.
L'équipe a exploré plusieurs protéines membranaires de notre système nerveux associées à des maladies afin de mieux comprendre comment nos cellules évitent que ces protéines défectueuses les endommagent et provoquent des maladies. Au cours de leurs recherches, ils ont observé qu'une protéase - une enzyme qui clive d'autres protéines - initie la dégradation des protéines mutantes défectueuses. Cette dégradation est essentielle au maintien de la fonction cellulaire. Cependant, ils n'ont pas été en mesure d'identifier la protéase impliquée. Tous les candidats connus et les inhibiteurs couramment utilisés ne nous ont pas aidés dans notre quête du mécanisme moléculaire sous-jacent", a déclaré Feige.
La percée a eu lieu après que les chercheurs ont identifié des sites de clivage potentiels pour le complexe signal peptidase. Selon les manuels établis, le complexe signal peptidase clive les peptides signaux pendant la maturation des protéines sécrétoires et, jusqu'à présent, on pensait que c'était sa seule fonction", a ajouté Mme Lemberg. Toutefois, les chercheurs ont identifié le complexe signal peptidase comme la protéase qu'ils recherchaient, révélant qu'il joue un rôle essentiel dans le contrôle de la qualité des protéines membranaires.
Par la suite, l'équipe interdisciplinaire de chercheurs a identifié plusieurs autres protéines qui sont clivées et comment cette fonction inattendue pourrait être régulée par la sous-unité de la peptidase signal SPCS1. Étant donné que ce facteur n'est pas essentiel pour le rôle initialement décrit dans la maturation des protéines, nous avons réalisé que nous avions affaire à une fonction jusqu'alors non reconnue", explique Feige.
Il est intéressant de noter que SPCS1 est l'un des trois seuls gènes qui sont régulés à la baisse dans toutes les régions du cerveau des patients atteints de la maladie d'Alzheimer, ce qui suggère que nos résultats pourraient avoir des implications importantes pour notre compréhension de la biologie humaine et des troubles associés à l'âge", a ajouté M. Lemberg. Dans la maladie d'Alzheimer, des protéines défectueuses s'accumulent, ce qui est censé altérer la fonction neuronale. Feige a conclu : Nos résultats nous aideront à mieux comprendre comment les cellules contrôlent la forme moléculaire de leurs protéines et jettent les bases de nombreuses études à venir".
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.






































