Lutter contre le cancer de l'ovaire
Le complexe rhénium-tricarbonyle à activité antitumorale cible la biogenèse des amas Fe-S
Les complexes métalliques ont occupé le devant de la scène dans la recherche de nouveaux médicaments anticancéreux aussi exempts d'effets secondaires que possible. Dans la revue Angewandte Chemie, une équipe de chercheurs vient de décrire comment une très faible dose d'un complexe métallique de rhénium interfère avec le métabolisme cellulaire au point de tuer les cellules cancéreuses de l'ovaire.
© Wiley-VCH
Le cisplatine a été le premier médicament antitumoral contenant du métal et d'autres ont été découverts depuis. Récemment, un nouveau médicament antitumoral potentiel a été découvert dans le TRIP, un complexe spécial de rhénium carbonyle. Le TRIP provoque une agrégation rapide des protéines, ce qui met le réticulum endoplasmique (RE) - où se produisent la synthèse, la modification et le repliement des protéines - sous tension, hyperactivant la réponse aux protéines non pliées (RPP). L'UPR est une réponse cellulaire à l'accumulation d'un grand nombre de protéines mal repliées dans le RE. Cela entraîne la mort cellulaire programmée (apoptose) des cellules tumorales.
Une équipe dirigée par Samuel M. Meier-Menches de l'Université de Vienne (Autriche) et Justin J. Wilson de l'Université Cornell (Ithaca, NY/USA) a analysé plus en détail les effets de TRIP en utilisant la chimioprotéomique. Cette méthode permet d'identifier les protéines cellulaires qui sont liées par un médicament. Malgré les effets toxiques étendus du TRIP, l'équipe a été en mesure d'identifier 89 protéines cibles cellulaires potentielles individuelles, dépendantes de la dose, dans une lignée de cellules cancéreuses ovariennes - c'est ce qu'on appelle le paysage des cibles du TRIP.
De plus, l'équipe a caractérisé la réponse de la lignée de cellules cancéreuses vivantes au traitement par TRIP en utilisant le profilage du protéome. Il s'agit de comparer le protéome, c'est-à-dire l'ensemble des protéines des cellules, avec et sans l'ajout de diverses doses du médicament et de noter les différences dans les concentrations de protéines individuelles.
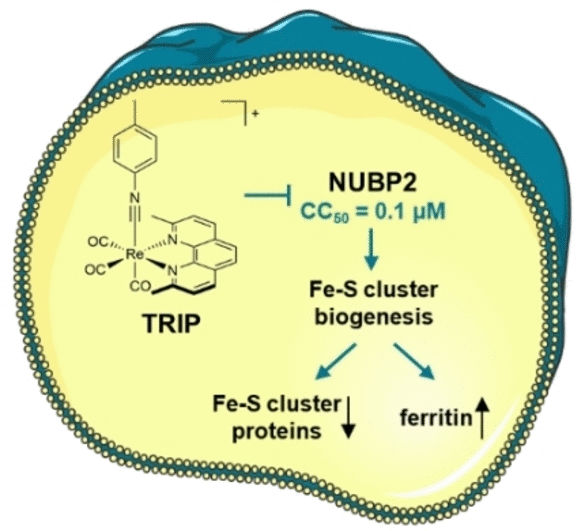
Dans l'ensemble, ces données indiquent que le facteur de biogénèse de l'amas Fe-S NUBP2 est le point de départ probable des processus cellulaires déclenchés par TRIP. Les amas Fe-S sont des complexes composés de plusieurs atomes de fer et de soufre. En tant que cofacteurs, ils jouent un rôle important dans de nombreuses réactions enzymatiques, comme la chaîne respiratoire. NUBP2 est essentiel pour la production de protéines avec des clusters Fe-S. Le traitement avec TRIP a réduit de manière significative le nombre de protéines Fe-S dans les cellules cancéreuses ovariennes. La quantité de ferritine, une protéine de stockage du fer, a augmenté de manière drastique. L'absence de protéines à groupements Fe-S pour la respiration cellulaire a été corroborée par la bioénergétique des cellules tumorales.
Le TRIP perturbe la biogénèse des amas de Fe-S dans les cellules cancéreuses ovariennes à des doses si faibles qu'elles ne sont généralement pas cytotoxiques. Cela en fait un point de départ intéressant pour le développement d'un médicament antitumoral sélectif ayant peu d'effets secondaires indésirables. Cette nouvelle méthode de recherche combinée pourrait être utilisée à grande échelle pour étudier la polypharmacologie (effet sur diverses cibles) des candidats médicaments à base de métaux.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.