Kampf dem Eierstockkrebs
Rhenium-Tricarbonyl-Komplex mit Antitumorwirkung zielt auf Fe-S-Cluster-Biogenese ab
Anzeigen
Bei der Suche nach neuen möglichst nebenwirkungsfreien Krebs-Wirkstoffen, die gezielt gegen ansonsten schwer therapierbare Tumorarten helfen sollen, sind metallhaltige Komplex-Verbindungen ins Zentrum des Interesses gerückt. Ein Forschungsteam beschreibt in der Zeitschrift Angewandte Chemie, auf welche Weise eine Verbindung des Metalls Rhenium in sehr niedriger Dosis so in den Zellstoffwechsel eingreift, dass er Eierstockkrebs-Zellen abtötet.
© Wiley-VCH
Cisplatin war der erste metallhaltige Antitumor-Wirkstoff, inzwischen sind weitere bekannt geworden. Erst kürzlich wurde mit TRIP, einem speziellen Rhenium-Carbonyl-Komplex, ein neuer potenzieller Antitumor-Wirkstoff gefunden. TRIP verursacht eine rasche Protein-Aggregation, die den Ort der Protein-Synthese, -Modifikation und -Faltung, das Endoplastmatische Retikulum (ER), unter Spannung setzt und die Unfolded Protein Response (UPR) überaktiviert. Die UPR ist eine zelluläre Antwort auf eine größere Menge nicht richtig gefalteter Proteine im ER. Folge ist der programmierte Zelltod (Apoptose) von Tumorzellen.
Das Team um Samuel M. Meier-Menches von der Universität Wien und Justin J. Wilson von der Cornell University (Ithaca, NY, USA) hat die Wirkung von TRIP nun genauer mittels Chemoproteomik analysiert. Dabei wird identifiziert, an welche zellulären Proteine ein Wirkstoff bindet. Trotz des breiten toxischen Effekts von TRIP gelang es dem Team, in einer Eierstockkrebs-Zelllinie 89 einzelne, dosisabhängige potenzielle zelluläre Ziele („Targets“) als Angriffspunkte auszumachen – die sogenannte Target-Landscape von TRIP.
Außerdem charakterisierte das Team die Antwort der lebenden Krebszellinie auf die Behandlung mit TRIP durch Proteom-Profiling. Dazu wird das Proteom, d.h. die Gesamtheit der Proteine der Zellen, ohne und mit Zugabe verschiedener Dosen des Wirkstoffs verglichen und Unterschiede in der Konzentration der einzelnen Proteine registriert.
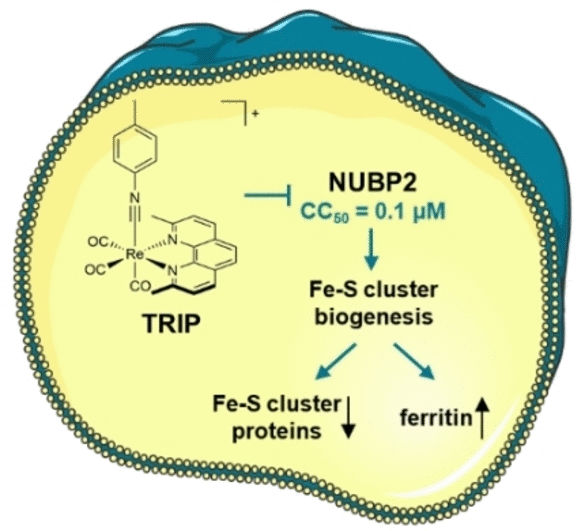
Zusammengenommen weisen die Daten auf den Fe-S-Cluster-Biogenese-Faktor NUBP2 als wahrscheinlichen Ausgangspunkt für die durch TRIP ausgelösten zellulären Vorgänge hin. Fe-S-Cluster sind Komplexe aus mehreren Eisen- und Schwefelatomen, die als Co-Faktoren eine wichtige Rolle bei vielen enzymatischen Reaktionen spielen, z.B. der Atmungskette. NUBP2 ist für die Bildung von Proteinen mit Fe-S-Clustern essenziell. Die Behandlung mit TRIP verringerte die Menge der Fe-S-Proteine in Eierstockkrebs-Zellen deutlich. Die Menge des Eisenspeicherproteins Ferritin war drastisch erhöht. Der Mangel an Fe-S-Cluster-Proteinen in der Zellatmung konnte anhand der Bioenergetik der Tumorzellen untermauert werden.
TRIP stört die Biogenese von Fe-S-Clustern in Eierstockkrebs-Zellen bereits in Dosen, die so gering sind, dass sie noch nicht allgemein cytotoxisch wirken. Es ist damit ein interessanter Ausgangspunkt für einen selektiv wirkenden Antitumorwirkstoff mit wenig unerwünschten Nebenwirkungen. Der neue, kombinierte Forschungsansatz könnte generell angewendet werden, um die Polypharmakologie Metall-basierter Wirkstoffkandidaten zu untersuchen, d.h. deren Wirkung auf verschiedene Targets.























































