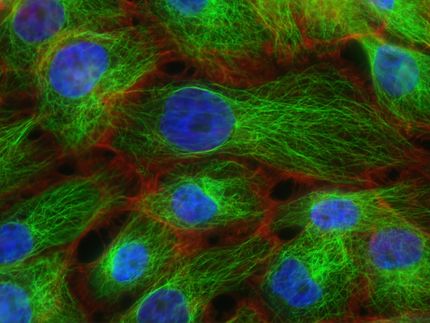
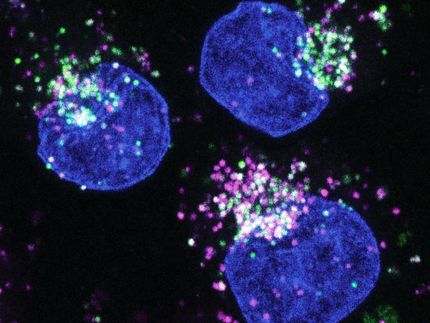
En directo: cambios inducidos por el estrés en generaciones de células cancerosas
Las células cancerosas responden al estrés con mayor diversidad. Los fármacos que afectan a la replicación del ADN, o la radiación que causa daños directos en el ADN, dan lugar a una descendencia cada vez más diversa a lo largo de múltiples generaciones celulares. Esto aumenta la complejidad genética del tumor y facilita el desarrollo de resistencia a la terapia. Los investigadores del UZH han estudiado ahora la aparición de la diversidad celular en tiempo real.
Las células son las unidades más pequeñas de la vida. Pero incluso dentro de un mismo tejido u órgano, no todas son idénticas. Durante la proliferación celular surgen continuamente nuevas variaciones. Mientras que las mutaciones genéticas alteran la secuencia del ADN, los cambios epigenéticos influyen en la actividad de los genes. La diversidad celular resultante tiene un doble filo: Por un lado, la heterogeneidad favorece el desarrollo y la adaptación al estrés. Por otro, puede provocar enfermedades como el cáncer o reducir la eficacia de las terapias.
Seguimiento en tiempo real del desarrollo de las células cancerosas
Aún no se ha estudiado en detalle cómo surgen en las células estas diferencias en el genoma y en el control epigenético, y cómo se transmiten a sus células hijas y nietas. Ahora, investigadores de la Universidad de Zúrich (UZH) han ideado un método que permite seguir en directo al microscopio cómo se desarrollan las células y cómo surge la heterogeneidad celular a lo largo de varias generaciones celulares.
Mediante la edición del genoma basada en CRISPR, unieron marcadores fluorescentes a dos proteínas: una para seguir el proceso de replicación del ADN y otra para marcar los daños adquiridos en el ADN. "Esto nos permitió monitorizar a lo largo de varias generaciones celulares cómo responden las células cancerosas a diferentes factores de estrés y cómo esto aumenta la heterogeneidad dentro de la población celular", explica Merula Stout, estudiante de doctorado de la UZH en el Departamento de Mecanismos Moleculares de la Enfermedad y coprimera autora del estudio.
Las células hijas varían significativamente tras el estrés
Además de las mediciones en tiempo real bajo el microscopio, los investigadores examinaron varios criterios de valoración, como la intensidad de las distintas señales de estrés en las células hijas y nietas. A continuación, superpusieron estas mediciones a la trayectoria de desarrollo observada de las mismas células. "Utilizando estos análisis del árbol genealógico celular, pudimos demostrar que las células hijas ya no se comportaban de forma sincronizada tras la división celular si la célula madre estaba expuesta a estrés", afirma Stout.
Según el investigador, se encontraron diferencias significativas, por ejemplo, en el inicio y la duración de la replicación del ADN y en la producción de proteínas que regulan el ciclo celular. Estas diferencias continuaron en la siguiente generación celular, aumentando así la heterogeneidad en la población celular. Por tanto, el daño y el estrés del ADN no sólo tienen consecuencias a corto plazo, sino también efectos a largo plazo sobre la diversidad de las células.
Las copias múltiples del genoma favorecen la resistencia a la terapia
El rastreo celular asistido por ordenador también ha proporcionado información directa sobre cómo surge la poliploidía en las células. En este proceso, las células cancerosas reciben múltiples copias del genoma. Esto, a su vez, aumenta la complejidad genética, lo que permite a las células adaptarse más rápidamente y desarrollar mecanismos de resistencia contra los fármacos.
La combinación de mediciones en tiempo real y finales demostró que las distintas vías hacia la poliploidía tienen efectos diferentes sobre la estabilidad del genoma, lo que influye en la aptitud de las células. "Ahora comprendemos mejor cómo se desarrollan las células con múltiples copias de su genoma. Potencialmente, nuestros hallazgos pueden servir para modular la poliploidía y adaptar mejor las terapias", afirma Andreas Panagopoulos, postdoctorando de la UZH y coautor del estudio.
Sólo la punta del iceberg
Este estudio es el primero que muestra en detalle cómo distintos mecanismos influyen en la estabilidad genética a través de múltiples generaciones celulares y aumentan la heterogeneidad entre células individuales. El equipo de investigación dirigido por el catedrático de la UZH Matthias Altmeyer pretende seguir desarrollando y automatizando el método en colaboración con las plataformas tecnológicas de la UZH. "Para cuestiones de investigación relacionadas principalmente con análisis de heterogeneidad unicelular y compleja en lugar de efectos medios, se requieren grandes cantidades de datos obtenidos en alto rendimiento, y analizarlos puede beneficiarse de la ayuda de la IA. Es muy probable que actualmente sólo veamos la proverbial punta del iceberg", afirma Altmeyer, jefe del grupo.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Andreas Panagopoulos, Merula Stout, Sinan Kilic, Peter Leary, Julia Vornberger, Virginia Pasti, Antonio Galarreta, Aleksandra Lezaja, Kyra Kirschenbühler, Ralph Imhof, Hubert Rehrauer, Urs Ziegler, Matthias Altmeyer; "Multigenerational cell tracking of DNA replication and heritable DNA damage"; Nature, 2025-5-21