Herzinfarkt: Botschaft blockiert
LMU-Forschern ist es gelungen, die Ansammlung von Monozyten an einer Entzündungsstelle zu stoppen. Dafür haben sie im Labor ein Peptid entwickelt, das einen entscheidenden chemischen Signalweg stört.
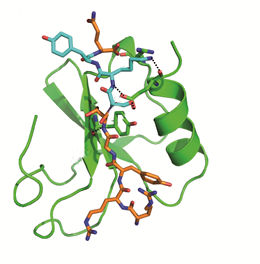
Gezeigt ist die Bindung von SKY Peptid an CCL5 (grün). Diese Bindung verhindert das Andocken von HNP1 und somit die Funktion des HNP1-CCL5 Heteromers. Die Monozyten können somit nirgendwo andocken und wandern in der Blutbahn weiter.
LMU
Monozyten spielen eine wesentliche Rolle bei der Immunabwehr. Die weißen Blutkörperchen können aber auch zur Gefahr für den eigenen Körper werden, wenn sie sich in großen Mengen an der inneren Gefäßwand ansammeln und dadurch Entzündungen auslösen. Forscher um Professor Oliver Söhnlein vom Institut für Prophylaxe und Epidemiologie der Kreislauferkrankungen (IPEK) der LMU ist es gelungen, die Ansammlung von Monozyten in entzündeten Geweben zu stoppen.
Verschiedene chemische Signalwege sorgen dafür, dass die Monozyten an der Gefäßwand anheften und schließlich in diese eindringen. Die Forscher um Oliver Söhnlein haben untersucht, in welcher Weise Neutrophile, die häufigsten weißen Blutkörperchen, und Blutplättchen bei der Aktivierung von Monozyten kooperieren. „Beide haben in ihren Zellkörpern Vesikel mit Proteinen, die sie freisetzen können, sobald sie am Gewebe kleben“, sagt Söhnlein. Die Proteine formen zusammen Heteromere, die als Andockstation für die Monozyten fungieren und ihnen überhaupt erst ermöglichen, an der Gefäßinnenwand zu haften.
Fatale Signale
„Diese Heteromere eignen sich als therapeutisches Angriffsziel. Wenn sich ihre Bildung verhindern lässt, fehlt der Signalweg, durch den die Monozyten sonst an die Gefäßinnenwand binden“, sagt Oliver Söhnlein. Um diesen Prozess zu unterbinden, haben die Forscher die Interaktion von Proteinen aus Neutrophilen und Plättchen genauer analysiert. Auf Basis einer Strukturanalyse der von ihnen freigesetzten Proteine, haben sie ein eigenes Molekül entwickelt, das SKY-Peptid. „Es ist HNP1, einem Protein, das von den Neutrophilen freigesetzt wird, strukturell sehr ähnlich“, sagt Söhnlein. Mithilfe des SKY-Peptids lässt sich die Interaktion stören: Das SKY-Peptid bindet an das Protein CCL5, das von den Plättchen freigesetzt wird. Ohne die Interaktion von HNP1 und CCL5 können sich keine Heteromere bilden. Die Monozyten können somit nirgendwo andocken und wandern in der Blutbahn weiter.
„Das Peptid SKY hat das höchstmögliche Potenzial, die Interaktion zwischen CCL5 und HNP1 zu stören“, sagt Söhnlein. Dabei stört SKY nicht die grundsätzliche Funktion der beiden Botenstoffe, sondern verhindert nur die Bildung von Heteromeren. „Die reguläre Immunantwort wird durch SKY also nicht beeinträchtig“, sagt Söhnlein, der inzwischen das SKY-Peptid zum Patent angemeldet hat.
Die IPEK-Forscher haben die Interaktion von Neutrophilen und Plättchen in der aktuellen Studie am Beispiel eines Herzinfarkts untersucht. „Doch dieser grundsätzliche Mechanismus ist immer dann relevant, wenn Neutrophile und Plättchen parallel aktiviert werden. Wir gehen davon aus, dass er sich auf verschiedene Erkrankungen übertragen lässt“, sagt Söhnlein. In ihrer Studie haben die Forscher nur die Interaktion der Signalproteine CCL5 und HNP1 untersucht. „Es ist nicht ausgeschlossen, dass auch andere Signalbotenstoffe miteinander interagieren und bestimmte Wirkungen hervorrufen. Unter anderen Bedingungen könnten auch andere Heteromere relevant sein.“ Um einen möglichen therapeutischen Nutzen ihres Ansatzes zu überprüfen, sind daher weitere Untersuchungen notwendig. „Unsere Ergebnisse weisen auf jeden Fall darauf hin, dass die gezielte Störung ausgewählter Signalwege ein therapeutischer Ansatzpunkt sein könnte“, sagt Oliver Söhnlein.