Ein neues Werkzeug für die Kryo-Elektronenmikroskopie
Kryo-EM mit einer sonst in der Materialforschung genutzten Methode kombiniert
Anzeigen
Forschende des Forschungszentrums Jülich und der Heinrich-Heine-Universität Düsseldorf um Prof. Dr. Carsten Sachse machen Biomoleküle mittels Kryo-Elektronenmikroskopie, kurz: Kryo-EM, auf atomarer Ebene sichtbar. In einer jetzt in der Fachzeitschrift Nature Methods erschienenen Publikation stellen sie ein neues Verfahren vor, das die Kryo-EM mit einer sonst in der Materialforschung genutzten Methode kombiniert. Die Ergebnisse werden auch in einem Nature Briefing vorgestellt und eingeordnet.
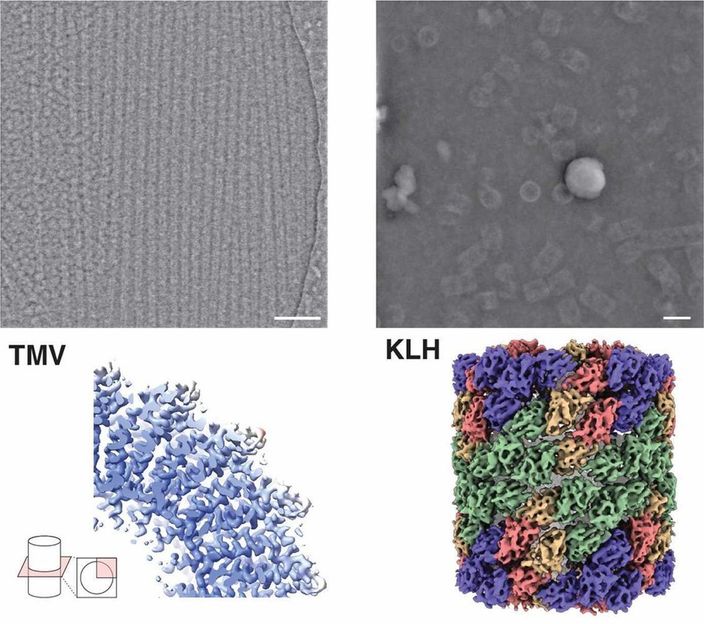
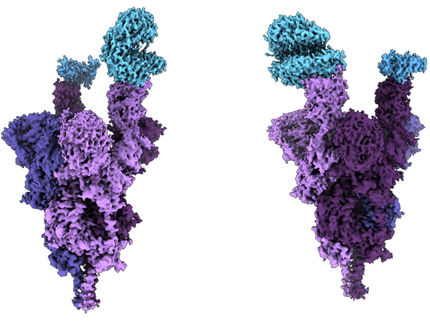
Aufnahme (oben) und Struktur (unten) des Proteins Hämocyanin (rechts) sowie des Tabakmosaikvirus (links) mittels iDPC-STEM. Unten die dazugehörigen 3D Strukturen bei 3,5 sowie 6,5 Å Auflösung.
Forschungszentrum Jülich / Ivan Lazic, Carsten Sachse
Die noch relativ junge Technik der Kryo-EM hat im Vergleich zu der seit Jahrzehnten etablierten Röntgenkristallographie einen entscheidenden Vorteil: Eiweißbausteine, Proteine, lassen sich damit im schockgefrosteten Zustand in ihrer natürlichen Umgebung beobachten, ohne sie zuvor zu einem künstlichen Kristall umbauen zu müssen. Üblicherweise kommt, nach dem Schockfrosten, das Verfahren der Transmissionselektronenmikroskopie zum Einsatz. Bei der alternativen Methode, die die Forscher:innen nun angewendet haben, handelt es sich dagegen um eine Weiterentwicklung der Rastertransmissionselektronenmikroskopie mit integrierten differentiellem Phasenkontrast, kurz iDPC-STEM.
„Dieses Verfahren ist bislang vorrangig in der Materialforschung zur Anwendung gekommen und hat dort bereits zu sehr hohen Auflösungen geführt. Bei der Untersuchung biologischer Proben haben wir damit nun direkt eine Abbildungsqualität erreicht, wie sie vor einigen Jahren durch die Kryo-Elektronenmikroskopie erstmals möglich wurde“, erläutert Prof. Carsten Sachse, Direktor am Ernst-Ruska-Centrum des Forschungszentrums Jülich und Professor an der Heinrich-Heine-Universität Düsseldorf.
Gemeinsam mit Forschungspartnern des Analytik-Unternehmens Thermo Fischer Scientific in Eindhoven konnte er Proteinstrukturen mittels iDPC-STEM mit einer Auflösung im Sub-Nanometerbereich von 3,5 Angström darstellen. „Die Kryo-Elektronenmikroskopie ist im Vergleich dazu heute bereits etwas weiter fortgeschritten. Aber unsere Ergebnisse zeigen, dass iDPC-STEM prinzipiell in der Lage ist, mit einigen Optimierungen ähnliche Auflösungen wie die heutige Kryo-EM zu erzielen und die Möglichkeiten der Strukturanalyse zu erweitern; insbesondere bei sehr heterogenen, ungleichmäßigen Proben oder einzelnen Partikeln, wenn die Möglichkeiten der Mittelung begrenzt sind“, so Sachse.
Bei der herkömmlichen Kryo-Elektronenmikroskopie werden Tausende, manchmal auch Zehn- oder Hunderttausende Schnappschüsse einer Probe aus unterschiedlichsten Blickrichtungen aufgenommen. Ein leistungsstarker Computer errechnet daraus anschließend ein detailliertes dreidimensionales Bild des Moleküls oder Partikels. Die Rasterelektronenmikroskopie tastet Objekte dagegen in winzigen Schritten zeilenweise ab und erzeugt so ein zusammengesetztes Bild, das ebenso viele Biomoleküle enthält und wie bei der herkömmlichen Kryo-EM als Grundlage für die dreidimensionale Strukturberechnung dient. Der eingesetzte Elektronenstrahl ist wie auch bei der Kryo-Elektronenmikroskopie äußerst niedrig dosiert. Denn Biomoleküle sind typischerweise äußerst empfindlich. So wird verhindert, dass die hohe Energie des Strahls die empfindlichen Strukturen zerstört.