Identifizierung der molekularen Struktur eines der klebrigeren Verursacher von Alzheimer
Anzeigen
In einer neuen Studie, die in Proceedings of the National Academy of Sciences veröffentlicht wurde, sind Forscher der University of Colorado Denver und der Binghamton University die ersten, die die molekulare Struktur und Dynamik einer aggressiven Proteinmodifikation kartieren, die die Alzheimer-Krankheit fördert.
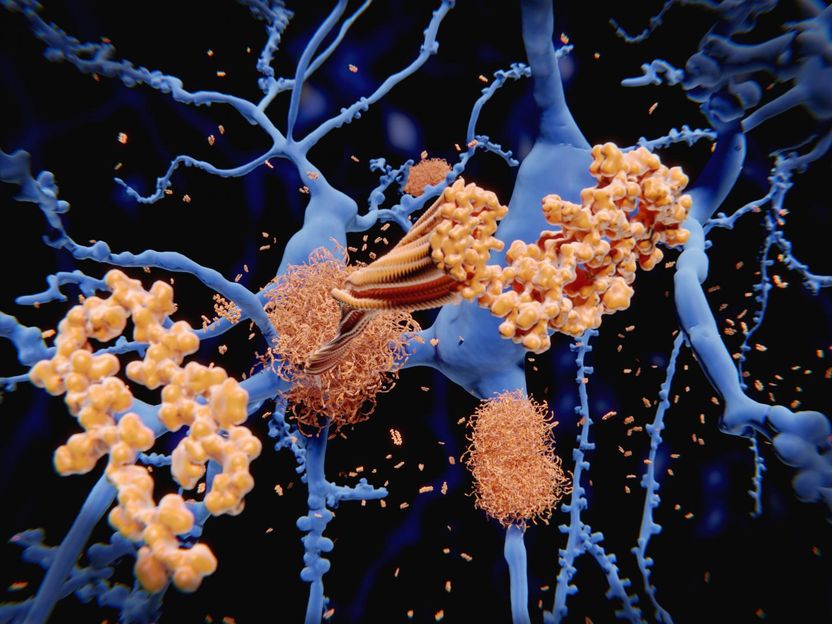
Alzheimer-Krankheit: Das Amyloid-beta-Peptid sammelt sich zu Amyloid-Fibrillen an, die dichte Amyloid-Plaques bilden. 3D-Rendering
Royalty-free stock photo ID: 1157052994
"Etwa zehn Prozent der Fälle von Alzheimer sind das Ergebnis identifizierter Mutationen", sagt Liliya Vugmeyster, PhD, Associate Professorin am Department of Chemistry des College of Liberal Arts & Sciences an der CU Denver. "Aber 90 Prozent der Alzheimer-Fälle sind nicht durch diese Mutationen erklärt, weshalb wir die molekulare Basis der Krankheit verstehen müssen."
Die Alzheimer-Krankheit beginnt Jahrzehnte vor dem Auftreten der Symptome. Es beginnt den Tag, an dem mikroskopisch kleine, toxische Proteinfragmente, sogenannte Beta-Amyloide (Aβ), aufeinandertreffen. Diese Klumpen bilden Ketten, die Fibrillen genannt werden, die sich zu einem klebrigen, plissierten Blatt zusammenfügen, das auf Gehirnzellen wie Plaque aufbaut. Durch die Anhäufung der Plaque werden die Zellmembranen und die Kommunikation zwischen den Gehirnzellen gestört, wodurch sie sterben. Bislang hat das Verständnis nur der molekularen Zusammensetzung der Proteine - und der aggressiveren Subtypen, die eine schnelle Beschleunigung der Krankheit verursachen - die Forscher geplagt.
In dieser Gemeinschaftsstudie mit Wei Qiang, Assistenzprofessor für biophysikalische Chemie an der Binghamton University, haben sich die Forscher mit der Struktur und der Dynamik der aggressiven Ser-8-phosphorylierten 40-Rückstände Aβ (pS8-Aβ40) Fibrillen beschäftigt. Sie fanden heraus, dass, selbst wenn es in kleineren Mengen existierte, pS8-Aβ40 als Alpha im Strukturpolymorphismus fungierte. Es hatte auch ein höheres Maß an Zelltoxizität im Vergleich zu anderen Fibrillen. Bei der Betrachtung der Molekularstruktur fanden die Forscher heraus, dass der N-Terminus, der Entstehungspunkt des Proteins, eine wichtige Rolle bei der Manipulation sowohl der Fibrillenstrukturen als auch der Aggregationsprozesse spielt.
Vugmeyster studierte zusammen mit dem Studenten Dan Fai Au, M.S., und Dmitry Ostrovsky, Dozent für Mathematik und Statistik, die Flexibilität der Fibrillen. In früheren Forschungen stellte Vugmeyster fest, dass Flexibilität Teil des Kontrollmechanismus für die Plaqueakkumulation sein könnte.
"Fibrillen sind sehr widerstandsfähig gegen Behandlungen, die eine Aggregation verhindern", sagt Vugmeyster. "Was auch immer du ihnen in den Reagenzgläsern antust, sie passen sich an, finden einen Weg, um in einen toxischen Zustand zu gelangen."
Vugmeyster sagt, dass die Abbildung der Struktur von pS8-Aβ40 nur das erste Teil eines größeren Puzzles ist. Qiangs Gruppe in Binghampton und ihr Teamplan machen dasselbe für mehrere wichtige Proteinmodifikationen, wobei sie sich auf die statische Struktur, Dynamik und Stabilität jedes einzelnen konzentrieren. Schließlich, sagt sie, könnten diese Informationen eines Tages zu Ideen führen, wie man Medikamente entwickeln kann, die den Teufelskreis der Zelldegeneration durchbrechen können.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.























































