Wie können sich Bakterien anpassen, um einer Behandlung mit Antibiotika zu widerstehen?
Anzeigen
In einer gemeinsamen Kooperation haben Forscher aus Dänemark und der Schweiz gezeigt, dass Bakterien ein bestimmtes Stressmolekül produzieren, sich langsamer teilen und so Energie sparen, wenn sie Antibiotika ausgesetzt sind. Die neuen Erkenntnisse sollen die Grundlage für die Entwicklung einer neuen Art von Antibiotika bilden.
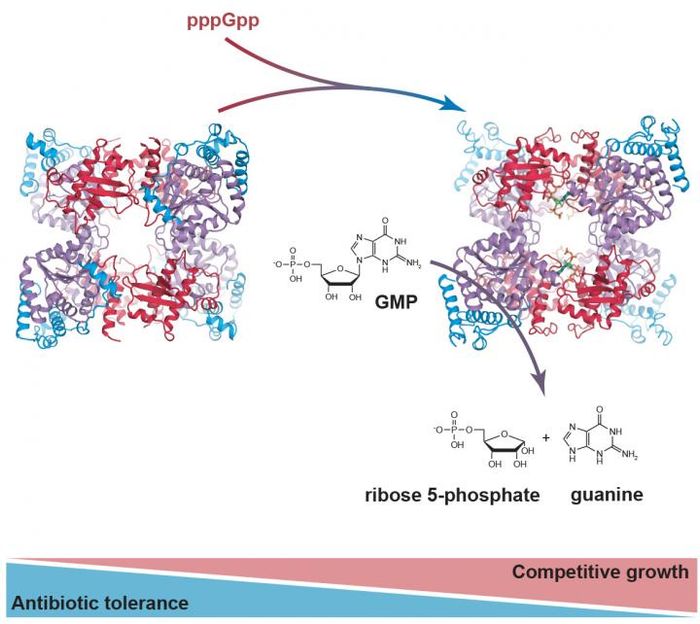
Die Abbildung zeigt, wie das Enzym PpnN pppGpp bindet und die Umwandlung von Guanylat (GMP) in seine Bestandteile Ribose-5-phosphat und Guanin beschleunigt. So können Bakterien ihre Toleranz gegenüber Antibiotika mit den Anforderungen an die Überlebensfähigkeit in Einklang bringen (unten).
Ditlev E. Brodersen/AU
Alle freilebenden Organismen stehen unter ständigem Überlebensdruck. Darwin nannte dies "Überleben des Stärkeren" und beschrieb so, wie die am besten angepasste Art die meisten Nachkommen haben würde und sich daher letztendlich selbst vermehren würde.
Dieses Grundprinzip ist besonders ausgeprägt in der Welt der Mikroorganismen, wo freilebende Bakterien in einem ständigen Kampf um die am besten angepasste und damit am schnellsten teilende Spezies in einem gegebenen natürlichen Lebensraum leben. Aber wenn Bakterien gleichzeitig tödlichen Antibiotika ausgesetzt sind, wird dieser Kampf zu einer Frage ausgleichender Fitness, d.h. der Fähigkeit zur schnellen Teilung, mit Toleranz gegenüber Antibiotika. Diese erstaunliche Anpassungsfähigkeit der Bakterien trägt zur Schwere der Infektionskrankheiten beim Menschen bei, einschließlich Tuberkulose und schwerer Harnwegsinfektionen, bei denen die Krankheit oft nach Beendigung der Behandlung wieder auftritt.
In einem neuen Forschungspapier, das in Molecular Cell veröffentlicht wurde, haben Forscher der Universität Aarhus mit Experten der Universität Kopenhagen und der Technischen Universität ETH Zürich in der Schweiz zusammengearbeitet und sich intensiv damit beschäftigt, wie Bakterien mit diesem schwierigen Balanceakt umgehen. Die Ergebnisse zeigen, dass Bakterien sehr schnell ihre Zellteilungsrate reduzieren, wenn sie Antibiotika ausgesetzt sind, um die höchstmögliche Toleranz zu erhalten, aber schnell wieder wachsen, wenn die Substanzen entfernt werden und Fitness der wichtigste Faktor ist.
Bakterien sparen Energie
Auf molekularer Ebene haben die Forscher in der Gruppe von Asc. Prof. Ditlev Egeskov Brodersen von der Abteilung für Molekularbiologie und Genetik der Universität Aarhus konnte zeigen, dass die Wirkung durch ein Enzym innerhalb der Bakterien vermittelt wird, das in der Lage ist, molekulare Energie in Form von Bestandteilen der zellulären DNA zu speichern, die für ein schnelles Nachwachsen bei Wegfall der Antibiotikabehandlung genutzt werden kann. Wenn die Bakterien Antibiotika ausgesetzt sind, beginnen sie sofort, die Substituenten der DNA (die sogenannten Nukleotide) in kleinere Teile zu zerlegen, die dann in der Zelle gespeichert werden.
Die Forscher haben gezeigt, dass Bakterien ein spezifisches Stressmolekül namens (p)ppGpp produzieren, wenn sie Antibiotika ausgesetzt sind, die das Enzym aktiver machen. Das bedeutet, dass die Energieeinsparung besonders schnell erfolgt, wenn die Bakterien Stress ausgesetzt sind. Mit einer fortschrittlichen Analysemethode, der Röntgenkristallographie, konnten die Forscher detaillierte 3D-Bilder des Enzyms erzeugen, sowohl im Normalzustand als auch an das Stressmolekül gebunden. Die Ergebnisse zeigen überraschend, dass sich das Enzym bei Vorhandensein des Stresshormons öffnet und damit viel effizienter funktioniert, da die Nukleotide leichter an die aktive Stelle gelangen können, an der der Abbau stattfindet.
Es wird erwartet, dass aus den neuen Erkenntnissen über die molekularen Grundlagen für die Reaktion von Bakterien auf Antibiotika eine ganz neue Art von Antibiotika entwickelt werden kann, die verhindern, dass Bakterien Energie sparen und sich so an die Behandlung anpassen.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.