Des virus zombies en plein détournement d'avion
Des séquences anciennes et dormantes du génome ont un impact inattendu sur le développement embryonnaire
Le génome des mammifères contient des séquences rétrovirales qui sont dans un état mort-vivant mais généralement "inoffensif". Une équipe de recherche internationale a récemment découvert comment certains de ces fragments de gènes rétroviraux affectent les cellules embryonnaires lorsqu'ils sont libérés. De manière inattendue, ce ne sont pas les protéines virales, mais plutôt des copies du matériel génétique lui-même qui génèrent un déséquilibre dans la cellule.

Image symbolique
Computer-generated image
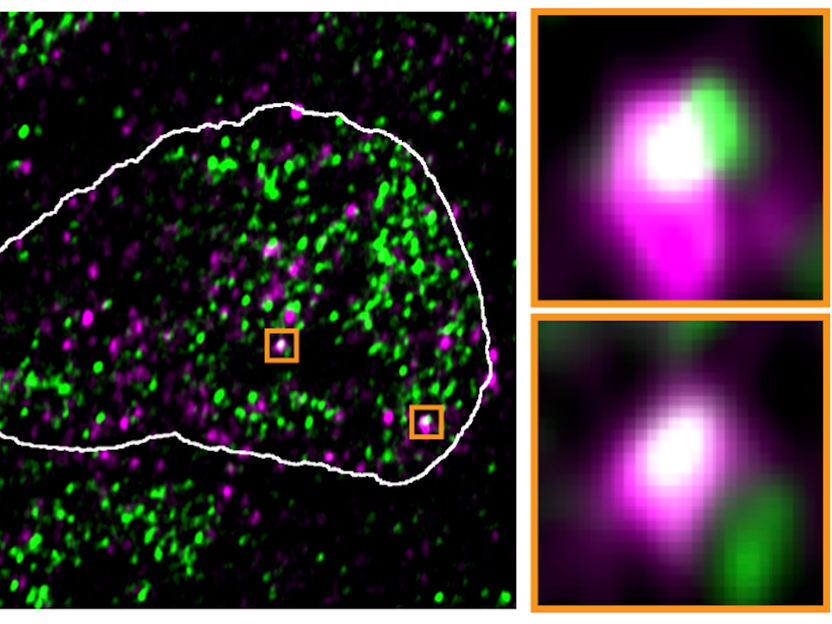
Dans le noyau des cellules souches de souris, les molécules d'ARN endovirales déréprimées (violet) apparaissent aux mêmes endroits que les condensats contenant l'ARN polymérase II (vert), comme le montre cette image obtenue par microscopie à fluorescence.
Asimi et al., MPIMG

Au cours de milliers d'années d'évolution, d'innombrables virus se sont incrustés dans notre génome. Un pourcentage stupéfiant de dix pour cent des génomes de mammifères est constitué d'anciennes séquences rétrovirales. Celles-ci ne semblent plus présenter aucun danger, car la plupart d'entre elles ont muté au point d'être méconnaissables. De plus, ces gènes ont été réduits au silence épigénétiquement par la cellule. Mais lorsque la mise au silence des restes viraux échoue, ils sortent de leur tombe, provoquant le chaos dans la cellule.
"Nous avons découvert que les copies messagères de certains gènes viraux, l'ARN, ont un impact important sur les cellules embryonnaires", explique Denes Hnisz, chef du groupe de recherche à l'Institut Max Planck de génétique moléculaire (MPIMG) de Berlin. "Les séquences virales semblent se souvenir de leur mission initiale, à savoir détourner la machinerie moléculaire qui assure le flux d'informations de l'ADN à l'ARN puis aux protéines. Il est intéressant de noter que l'ARN messager lui-même semble être responsable".
L'équipe de Hnisz et des chercheurs collaborateurs ont publié leurs résultats dans la revue Nature Genetics. Ils décrivent que l'ARN des virus ressuscités exerce des forces d'attraction sur les enzymes qui lisent les informations de l'ADN. Les tâches de la cellule embryonnaire - telles que la lecture des gènes embryonnaires importants - sont négligées et un déséquilibre fatal se développe. Cet état déchaîné se produit, par exemple, dans certains types de cancer et de maladies neurologiques.
Des restes viraux pour la plupart inoffensifs
Les virus sont des fragments d'informations génétiques astucieusement construits. Certains d'entre eux s'incorporent dans le génome de leurs hôtes et y persistent. Des milliers de copies de rétrovirus endogènes (ERV) se sont répandues dans les génomes des mammifères, souvent par centaines de copies répétitives.
"Comme les rétrovirus sautent d'une section d'ADN à l'autre au cours de leur cycle de vie, ils peuvent modifier les gènes et même les recombiner. Cela en fait un outil important de l'évolution pour créer de nouveaux gènes", explique Henri Niskanen, l'un des scientifiques ayant participé à l'étude. "Pour un organisme individuel cependant, la modification incontrôlée des gènes n'est pas de bon augure, en particulier pendant le développement embryonnaire."
C'est pourquoi la cellule va identifier les séquences ERV et recruter une machinerie répressive dédiée à leurs sites et les garder silencieuses. De plus, le chromosome se compacte sur ces sites.
Les virus ressuscités détournent la machinerie transcriptionnelle
Mais que se passe-t-il si l'on désactive ces mécanismes de protection ? L'équipe de recherche a voulu découvrir la toute première chose qui se produit lorsque les zombies ERV ne sont plus tenus en échec. À cette fin, ils ont retiré Trim28, une protéine responsable de la réduction au silence des restes viraux, des cellules souches embryonnaires de souris, et ont surveillé les conséquences immédiates.
Une fois que Trim28 a disparu, la cellule a, sans surprise, lu davantage de gènes du VRE, produisant des copies d'ARN avec l'aide de l'enzyme ARN polymérase. Mais de manière inattendue, la polymérase a simultanément disparu des gènes de la cellule souche qui sont particulièrement importants pour la puissance de la cellule souche.
"Seul un pool limité d'enzymes polymérases et d'autres facteurs nécessaires est disponible dans chaque cellule", explique Christina Riemenschneider, une autre chercheuse de l'équipe. Si trop de gènes sont transcrits en même temps, ils se disputeront les ressources limitées, explique-t-elle. Dans une expérience, des répétitions de séquences de VRE sont entrées en compétition avec des gènes de cellules souches. "Nous constatons que les répétitions de VRE ont une affinité légèrement supérieure - elles attirent la machinerie loin des gènes embryonnaires, créant ainsi un déséquilibre", explique Mme Riemenschneider.
Des forces d'attraction entre les molécules
L'ARN polymérase et d'autres facteurs nécessaires qui s'amarrent sélectivement aux gènes s'assemblent souvent en gouttelettes qui contiennent beaucoup de protéines et flottent dans le noyau cellulaire - un peu comme des gouttelettes d'huile dans une vinaigrette. Ces "condensats" contiennent de nombreuses molécules nécessaires à la lecture des gènes et sont particulièrement attirés par des segments d'ADN spécifiques qui contrôlent les gènes les plus importants d'une cellule.
Les gènes ERV, ou plutôt les molécules d'ARN produites à partir de ces gènes, semblent littéralement détourner les condensats. Sur les images microscopiques à haute résolution, ils se trouvaient souvent aux mêmes endroits que les gènes ERV réactivés. Une fois l'ARN viral retiré des cellules, les gouttelettes ont retrouvé leur emplacement d'origine.
Les effets de l'ARN de type viral ne se limitaient pas au niveau moléculaire. En travaillant sur des embryons précoces de souris, l'équipe de recherche a démontré que le déplacement des condensats vers les VRE avait des effets néfastes sur le développement. Les cellules souches, par exemple, ont perdu leur propriété typique de pouvoir se développer en n'importe quelle autre cellule, car les gènes nécessaires n'étaient plus actifs.
Pertinence pour l'évolution et le développement des maladies
"Il est tout à fait remarquable que des gènes non codants et non fonctionnels aient un effet aussi profond via l'ARN", explique le scientifique Abhishek Sampath Kumar, qui a participé aux travaux. "On pourrait imaginer des dommages à l'ADN ou des particules virales quand on pense aux rétrovirus qui s'intègrent dans le génome, mais ce n'est pas le cas ici."
Par conséquent, l'équipe de scientifiques affirme que leur découverte place la recherche sur les rétrovirus endogènes sous un nouveau jour. "Le détournement des condensats transcriptionnels par les VRE et leur ARN est une découverte mécanistique importante qui devrait être prise en compte dans les futures études sur les éléments transposables et leurs régulateurs épigénétiques", explique le chercheur Vahid Asimi, qui a travaillé sur l'étude. "Cela pourrait être une voie supplémentaire utilisée par les ERV pour contribuer à l'innovation évolutive".
"La réactivation des ERV est clairement liée à des pathologies, de l'obésité à divers cancers en passant par des maladies neurologiques comme la sclérose latérale amyotrophique et la schizophrénie", ajoute Denes Hnisz, chef de groupe. "Nous espérons que nos recherches contribueront à élucider les causes moléculaires de ces maladies."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Asimi V, Sampath Kumar A, Niskanen H, Riemenschneider C, Hetzel S, Naderi J, Fasching N, Popitsch N, Du M, Kretzmer H, Smith ZD, Weigert R, Walther M, Mamde S, Meierhofer D, Wittler L, Buschow R, Timmermann B, Cisse II, Ameres SL, Meissner A, Hnisz D. Hijacking of transcriptional condensates by endogenous retroviruses. Nat Genet. 2022 Aug;54(8):1238-1247.







































