Cómo puede ayudar la CRISPR a luchar contra las enfermedades neurodegenerativas
Científicos listaron formas de aplicar la ingeniería genética para tratar la enfermedad de Parkinson
Investigadores de la Universidad Sechenov y de la Universidad de Pittsburgh describieron las estrategias más prometedoras en la aplicación de la ingeniería genética para estudiar y tratar la enfermedad de Parkinson. Este método puede ayudar a evaluar el papel de varios procesos celulares en la progresión de la patología, desarrollar nuevos fármacos y terapias, y estimar su eficacia utilizando modelos de enfermedades animales.
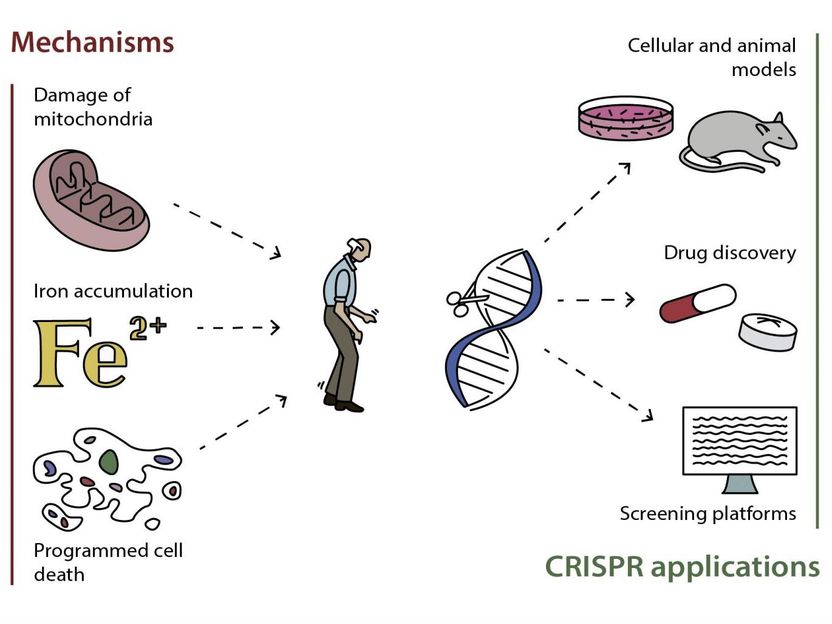
Posibles mecanismos de desarrollo de la enfermedad de Parkinson y las formas más prometedoras de aplicar CRISPR/Casas9 para su estudio y tratamiento.
Alena Manuzina
La enfermedad de Parkinson es un trastorno neurodegenerativo acompañado de una amplia gama de deficiencias motoras y cognitivas. Se desarrolla principalmente en personas mayores (después de los 55-60 años). Los síntomas del Parkinson generalmente comienzan gradualmente y empeoran con el tiempo. A medida que la enfermedad progresa, las personas pueden tener dificultades para controlar sus movimientos, caminar y hablar y, lo que es más importante, para cuidarse. Aunque no existe cura para la enfermedad de Parkinson, los medicamentos, el tratamiento quirúrgico y otras terapias a menudo pueden aliviar algunos síntomas.
La enfermedad se caracteriza por una pérdida significativa (hasta un 50-70%) de neuronas dopaminérgicas, es decir, células nerviosas que sintetizan el neurotransmisor dopamina que permite la comunicación entre las neuronas. Otro sello distintivo es la presencia de cuerpos de Lewy - depósitos oligoméricos de una proteína llamada alfa-sinucleína dentro de las neuronas.
Los científicos descubrieron varios mecanismos que parecen desencadenar y exacerbar el desarrollo de la enfermedad de Parkinson. En casi el 10% de los casos la enfermedad está predeterminada genéticamente, sin embargo, en la mayoría de los casos se cree que la enfermedad involucra factores de riesgo tanto genéticos como ambientales, por ejemplo, tomar algunos medicamentos o envenenamiento por pesticidas/herbicidas.
Los autores del estudio se centraron en las posibles causas de la enfermedad que están relacionadas con las reacciones de oxidación-reducción (redox) en las células, así como con los mecanismos de muerte celular -apoptosis y ferroptosis. Estos procesos fueron cuidadosamente discutidos en el contexto de la manipulación directa (por ejemplo, inserción o eliminación de secuencias de ADN) con material genético de organismos vivos o células mediante la aplicación de un nuevo enfoque de edición del genoma: la tecnología CRISPR/Cas9.
"La enfermedad de Parkinson es el segundo trastorno neurodegenerativo más común en el mundo, y su incidencia está aumentando con la edad. La enfermedad afecta la calidad de vida de los pacientes e impone una carga social y económica significativa a las sociedades. La CRISPR es una tecnología prometedora, una estrategia para encontrar nuevos tratamientos eficaces para las enfermedades neurodegenerativas. La tecnología ofrece a los investigadores una amplia oportunidad para introducir y eliminar cualquier gen de interés, definir los procesos en los que está involucrado y desenterrar vías metabólicas completas, con el fin de comprender los mecanismos subyacentes y las causas de la enfermedad. Se debe prestar especial atención a las aplicaciones de edición CRISPR para la creación de modelos celulares y animales que reproduzcan plenamente los estados patológicos observados en pacientes humanos, proporcionen información sobre los mecanismos subyacentes al trastorno y sean aplicables para el descubrimiento de fármacos", dice Margarita Artyukhova, coautora del trabajo, estudiante de 4º año del Instituto de Medicina Regenerativa de la Universidad Sechenov y miembro del Club Biomédico Sechenov.
El primer grupo de mecanismos vincula el papel de las mitocondrias con la patología de la enfermedad de Parkinson. Junto con ser potencias de la célula, las mitocondrias forman especies reactivas de oxígeno (ROS) que juegan un papel importante en la señalización celular y la homeostasis. El daño a las mitocondrias o la interrupción de su trabajo puede llevar a la acumulación extensiva de ROS que puede causar daño significativo a las estructuras celulares. Debido al peligro de tener mitocondrias dañadas en la célula, la eliminación oportuna de las mitocondrias dañadas y envejecidas es esencial para mantener la integridad de la célula. Esta rotación se conoce como mitofagia. La mitofagia ineficiente o excesiva puede contribuir a la neurodegeneración. Estudios previos demostraron que los animales con mutaciones en los genes que codifican para PINK1 y Parkin -proteínas esenciales para el correcto funcionamiento mitocondrial- desarrollaron disfunción mitocondrial, degeneración muscular y pérdida notable de neuronas dopaminérgicas típicas de la enfermedad de Parkinson. Los resultados de varios grupos de investigación sugirieron que el papel de estas proteínas podría ser mucho más complicado y podría involucrar a otros socios que contribuyen a la ejecución y regulación de la mitofagia, por lo tanto, el momento de implementar la edición del genoma para manipularlas aún está por llegar. Sin embargo, hay varias otras proteínas y lípidos que afectan la mitofagia y la función mitocondrial (DJ-1, alfa-sinucleína, Fbxo7 y cardiolipina), y CRISPR/Cas9 pueden utilizarse para buscar genes aún desconocidos y sus productos proteicos involucrados en la progresión y desarrollo de la enfermedad. Además, la generación de modelos animales y celulares con diversas mutaciones en los genes mencionados ayudará a definir el papel de las proteínas correspondientes en la patología de la enfermedad y a convertirlas en dianas para el descubrimiento de fármacos.
El segundo grupo de procesos celulares está relacionado con la homeostasis del hierro. Una cierta cantidad de hierro y ROS es importante para el buen funcionamiento de la célula, por lo tanto, la alteración de este equilibrio puede causar una cadena de alteraciones dañinas y patológicas que afectan los procesos celulares cruciales. El hierro puede acumularse en los tejidos cerebrales de las personas mayores y los animales, en particular en las áreas del cerebro responsables de las funciones motoras y cognitivas. Se demostró que un alto nivel de hierro en una de estas áreas (substantia nigra) va acompañado de la muerte de neuronas dopaminérgicas. Además, la interacción entre la dopamina y el hierro puede promover la producción de metabolitos tóxicos que causan daño a las mitocondrias y desencadenan la agregación de alfa-sinucleína en las neuronas. Los científicos también examinan las proteínas involucradas en la importación y exportación de hierro dentro de las neuronas: proteína tau, transferrina, receptor de transferrina, ferroportina y proteína precursora del amiloide. CRISPR/Cas9 puede ayudar en el desarrollo de medicamentos que normalizarán la homeostasis del hierro en los tejidos afectados.
El tercer grupo de procesos revisados en el artículo son los programas de muerte celular, apoptosis y ferroptosis. Durante la apoptosis, las proteínas y el ADN de la célula se descomponen con enzimas especiales y la propia célula se desintegra. La ferroptosis sigue a la oxidación dependiente del hierro de clases específicas de lípidos; los productos de la oxidación se acumulan y envenenan la célula. Tanto la apoptosis como la ferroptosis juegan un papel en el desarrollo de enfermedades neurológicas, acelerando la muerte de las neuronas dopaminérgicas. En este caso CRISPR/Cas9 será útil en estudios detallados de las vías de muerte celular que promueven la pérdida de neuronas dopaminérgicas asociadas a la enfermedad de Parkinson, así como en la regulación de enzimas y proteínas específicas que están involucradas en la ejecución de estos programas de muerte celular.
El análisis funcional del genoma, un enfoque poderoso para obtener información completa sobre el genoma completo, ayudó a obtener muchos de estos resultados, y ya ha demostrado su eficacia en la investigación sobre la esquizofrenia, el trastorno bipolar y el trastorno del espectro autista. Junto con la CRISPR/Cas9 puede contribuir a la comprensión de las bases genéticas de la enfermedad de Parkinson, promover la generación de modelos celulares y animales individuales, así como el diseño de nuevos fármacos y enfoques de tratamiento.
Este es un paso importante de muchos para llevar la promesa de esta nueva tecnología a los pacientes con enfermedades graves como los trastornos neurodegenerativos". Ya se ha utilizado en ensayos en humanos (en China, Alemania, EE.UU.) para tratar a pacientes con cáncer en estadio avanzado y beta-talasemia. Tales estudios nos permiten ver el vasto potencial de la edición del genoma como una estrategia terapéutica. Es difícil no estar emocionado y emocionado cuando se entiende que el progreso de las tecnologías de edición del genoma puede cambiar completamente nuestra comprensión del tratamiento de la enfermedad de Parkinson y otros trastornos neurodegenerativos", añadió Margarita Artyukhova.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.