Bessere Genombearbeitung
Verfahren ermöglicht vollständige spatiotemporale Kontrolle und behandelt die DNA schonend
Anzeigen
Ein Haupthindernis für die Bearbeitung des Genoms in der Zelle ist, nun ja, die Zelle selbst.
"Menschliche Zellen mögen es nicht, Dinge aufzunehmen", erklärt Norbert Reich von der UC Santa Barbara, Professor am Institut für Chemie und Biochemie. Die menschliche Zelle hat einen "Abfallentsorgungsmechanismus" entwickelt, der Fremdproteine und andere unerwünschte Biomoleküle, Krankheitserreger und sogar geschädigte Zellstrukturen isoliert und abbaut, erklärte er. Für Menschen aus den Bereichen Biotechnologie, Biopharmakologie und Genomforschung und Therapeutik - wie z.B. mit der CRISPR-Cas9-Technologie - arbeiten, sind die Ergebnisse also nur so gut wie ihre Fähigkeit, diesen Abwehrmechanismus effizient zu umgehen und Proteine exakt in tierische Zellen einzubringen.
Reich und sein Team haben eine solche Methode entwickelt. Ihre Technik, die schätzungsweise 100 bis 1.000 Mal effizienter ist als die heutigen Methoden, ermöglicht dem Anwender eine vollständige räumlich-zeitliche Kontrolle der Genom-Editierung, so dass er genau entscheiden kann, wann und wo er Genom-Editing-Proteine freisetzt.
"Wir können tatsächlich einzelne Zellen treffen", sagte Reich. "Wir können sogar Teile einer Zelle treffen, so dass wir das Protein nur in einen Teil der Zelle freisetzen können. Aber der wichtigste Punkt ist, dass wir die Kontrolle darüber haben, wo und wann dieses Protein, das die DNA schneiden wird, freigesetzt wird."
Ein aufmerksamkeitsstarker Durchbruch in der Biotechnologie ist der Einsatz von Gen-Editing-Proteinen - "Genscheren" wie CRISPR, Cas und, in dieser Studie, Cre - zum Auffinden, Ausschneiden und Einfügen spezifischer Abschnitte von Ziel-DNA-Sequenzen. Ursprünglich ein Abwehrmechanismus von Bakterien und Archaeen, um DNA von angreifenden Viren zu erkennen und zur Zerstörung zu markieren, haben Wissenschaftler seither Methoden entwickelt, um Basenpaarsequenzen unterschiedlicher Länge mit verschiedenen Proteinen zu erkennen, zu schneiden und zu binden. Das Potenzial für diese Technologie ist enorm und reicht von der Grundlagenforschung, die die Funktion und Identifizierung von Genen bestimmt, bis hin zu Therapien, die Defekte auf zellulärer Ebene beheben könnten.
Schlüssel zur lichtgesteuerten Genombearbeitung der Arbeitsgruppe sind hohle Goldnanosphären, auf denen DNA-Reporterstränge (sie fluoreszieren rot) und eine Proteinfusion aus Cre-Rekombinase und zelldurchdringenden Peptiden aufgebracht sind und Nah-Infrarot-Licht.
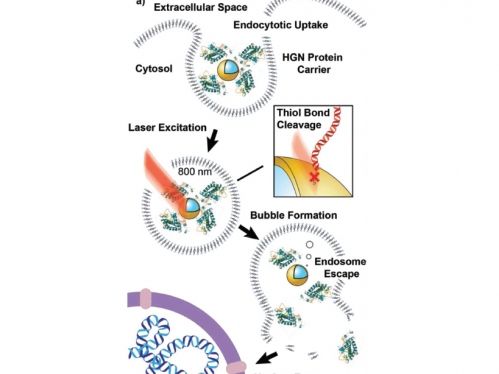
Die Methode der Arbeitsgruppe zur lichtaktivierten Abgabe von Gen-Editorenzymen
UCSB, Reich group
"Jetzt haben wir also ein Zielsuchgerät und einen Wirkstoff", sagte Reich und erklärte, dass die Cre-Rekombinase und die Peptidfusion als Zielsystem fungieren, eines, das ins Spiel kommt, wenn die Zielzelle ihren zellulären Müll entsorgt.
Einmal in die Zelle gebracht, wird die Nanohülle von einem Endosom umhüllt - einer Membrantasche, die sie isoliert und durch die Zelle transportiert.
"Aber die Nanohüllen tun nichts, weil sie gefangen sind", sagte Reich. Das ultraschnell gepulste Nahinfrarot-Laserlicht, das für Zellen unbedenklich ist und bei der Gewebedurchdringung effizient ist, wird dann auf die eingeschlossenen Nanoschalen und deren Proteinschichten gerichtet.
"Nah-Infrarot-Wellenlängen verursachen eine wirklich interessante Reaktion", sagte Reich. "Es regt die Goldnanoschale an und verursacht, dass alles, was wir gebunden haben, sich löst." Gleichzeitig bilden sich Nanoblasen, die Öffnungen im Endosom verursachen und dessen Proteininhalt entweichen lassen. Die Proteine sind nun frei im Zellkern, wo das genetische Material gespeichert ist, zu finden und gelangen mit dem zelldurchdringenden Peptid in die Zelle. Und Cre kann seine Reporterstränge finden, schneiden und in die Helix einfügen.
Das In-vitro-Experiment der Gruppe erwies sich als erfolgreich: Nach einer Inkubationszeit leuchteten die von den proteinbeschichteten Nanoschalen durchdrungenen Zellen rot.
"Wir haben nichts entwickelt, was die Zellen dazu bringen würde, sich anders zu verhalten", sagte Reich. "Wir haben es so gemacht, dass die Zelle wegen dieses fluoreszierenden Proteins anders aussieht."
Der Hauptautor des Papiers, Dean Morales, der jetzt Postdoktorand am Los Alamos National Laboratory ist, sagte: "Als Werkzeug der Grundlagenforschung kann jede Zelle mit raumzeitlicher Kontrolle zu einem Experiment werden. Stellen Sie sich vor, Sie möchten die Funktion eines bestimmten Gens untersuchen und wie es das Verhalten dieser Zelle oder ihr Verhalten mit einem engen Nachbarn verändert. Mit den plasmonischen Nanopartikeln als Antenne können wir ein interessierendes Gen ein- oder ausschalten und in Echtzeit die Auswirkungen seiner Aktivität beobachten."
Die räumlich-zeitliche Kontrolle erlaubt es auch denjenigen, die sie einsetzen, auf die Erbsubstanz zu achten, deren Neuschreibung, wie die Forscher bestätigen, sehr starke und transgenerative Effekte hat.
"In bestimmten Fällen, wie bei somatischen Mutationen, müsste nicht jede Zelle im Körper bearbeitet werden", sagte Morales. "Die Möglichkeit, zu steuern, wo und wann die Schnittmaschine eingesetzt werden kann, sorgt für eine transiente Bearbeitung. Wichtig dabei ist, dass aktuelle Ansätze der Genbearbeitung oft dazu führen, dass die Editiermaschine in aktiver Form in der Zielzelle belassen wird, mit unbekannten langfristigen Auswirkungen. Unser Ansatz liefert die Schnittmaschinen vorübergehend und umgeht so dieses Problem."
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Gentherapie
Genetische Erkrankungen, die einst als unbehandelbar galten, stehen nun im Zentrum innovativer therapeutischer Ansätze. Die Forschung und Entwicklung von Gentherapien in Biotech und Pharma zielen darauf ab, defekte oder fehlende Gene direkt zu korrigieren oder zu ersetzen, um Krankheiten auf molekularer Ebene zu bekämpfen. Dieser revolutionäre Ansatz verspricht nicht nur die Behandlung von Symptomen, sondern die Beseitigung der Krankheitsursache selbst.

Themenwelt Gentherapie
Genetische Erkrankungen, die einst als unbehandelbar galten, stehen nun im Zentrum innovativer therapeutischer Ansätze. Die Forschung und Entwicklung von Gentherapien in Biotech und Pharma zielen darauf ab, defekte oder fehlende Gene direkt zu korrigieren oder zu ersetzen, um Krankheiten auf molekularer Ebene zu bekämpfen. Dieser revolutionäre Ansatz verspricht nicht nur die Behandlung von Symptomen, sondern die Beseitigung der Krankheitsursache selbst.













































