Wie sich tödliche Biofilme bilden
Anzeigen
Durch die starke Einschränkung der Wirkung von Antibiotika kann die Bildung von organisierten Gemeinschaften von Bakterienzellen, den so genannten Biofilmen, während Operationen und bei Harnwegsinfektionen tödlich sein. Die Yale-Forscher sind dem Verständnis, wie sich diese Biofilme entwickeln und wie man sie möglicherweise stoppen kann, gerade viel näher gekommen.
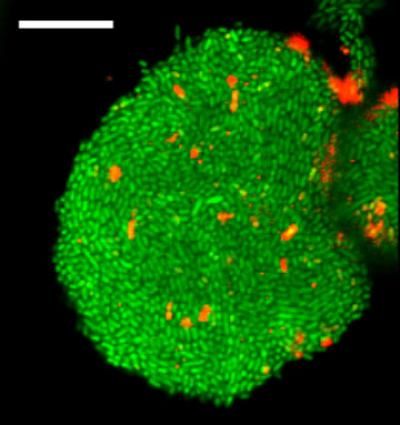
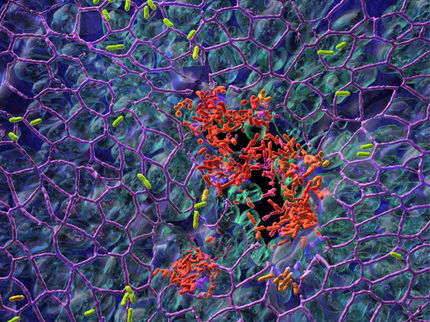
Dies ist ein Bild von Zellen, die einen Biofilm bilden, eine bakterielle Zellgemeinschaft, die vor Umweltstress geschützt ist und eine Quelle für Antibiotikaresistenz ist, in einem neuen Gelgerät, das im Levchenko-Labor entwickelt wurde.
Levchenko Lab/Yale University
Biofilme entstehen, wenn sich Bakterienzellen sammeln und Strukturen entwickeln, die sie in einer klebrigen Substanz verbinden. Dieser Klebstoff kann die Zellen vor der Außenwelt schützen und ihnen erlauben, komplexe Quasi-Organismen zu bilden. Biofilme sind fast überall zu finden, auch an ungewaschenen Duschkabinen oder an den Oberflächen von Seen. Da die schützende Hülle mögliche Behandlungen ausschließen kann, sind Biofilme am gefährlichsten, wenn sie in menschliche Zellen eindringen oder sich auf Nähten und Kathetern in Operationen bilden. Allein in amerikanischen Krankenhäusern werden Tausende von Todesfällen auf biofilmbedingte chirurgische Lokalinfektionen und Harnwegsinfektionen zurückgeführt.
"Biofilme sind ein großes medizinisches Problem, denn sie sind etwas, das den Umgang mit bakteriellen Infektionen sehr schwierig macht", sagt Andre Levchenko.
Die Bekämpfung von Biofilmen ist besonders schwierig, weil nicht gut verstanden wurde, wie Bakterienzellen den Übergang vom individuellen Verhalten zum Bestehen in kollektiven Strukturen schaffen. Die Forscher im Levchenko-Labor haben jedoch in Zusammenarbeit mit Kollegen der University of California-San Diego kürzlich einen Schlüsselmechanismus für die Biofilmbildung gefunden, der auch eine Möglichkeit bietet, diesen Prozess kontrolliert und reproduzierbar zu untersuchen.
Die Forscher entwarfen und bauten Mikrofluidikgeräte und neuartige Gele, die uropathogene E. coli-Zellen enthielten, die oft die Ursache für Harnwegsinfektionen sind. Diese Geräte ahmen die Umgebung in menschlichen Zellen nach, in denen sich die eindringenden Bakterien während einer Infektion befinden. Die Wissenschaftler fanden heraus, dass die Bakterienkolonien so weit wachsen würden, dass sie entweder von den Wänden der Kammer, den Fasern oder dem Gel zusammengepresst würden. Dieser selbst erzeugte Stress war selbst ein Auslöser der Biofilmbildung.
"Das war sehr überraschend, aber wir haben alles gesehen, was man von einem Biofilm erwarten kann", sagte Levchenko, der John C. Malone Professor für Biomedizinische Technik und Direktor des Yale Systems Biology Institute. "Die Zellen produzierten die Biofilm-Komponenten und wurden plötzlich sehr antibiotikaresistent. Und all das ging einher mit einem Anzeichen dafür, dass die Zellen unter biologischem Stress standen und der Stress aus dieser mechanischen Interaktion mit der Umwelt kam."
Mit dieser Entdeckung, sagte Levchenko, können Forscher verschiedene Geräte verwenden, die andere Zellumgebungen nachahmen und die Biofilmbildung unter unzähligen Umgebungen und Umständen erforschen. Mit den in dieser Studie vorgestellten Geräten können sie Biofilme auch schnell, präzise und in hoher Stückzahl auf einfache, kostengünstige und reproduzierbare Weise produzieren. Dies würde es ermöglichen, Medikamente zu testen, die möglicherweise die Schutzschicht der Biofilme durchbrechen und abbauen könnten.
"Ein solches Krankheitsmodell zu haben, ist ein Muss, wenn man diese Art von Drogenscreening-Experimenten durchführen will", sagte er. "Wir können jetzt Biofilme in bestimmten Formen und an bestimmten Orten auf eine völlig vorhersehbare Weise züchten."