Wenn Proteinkristalle wachsen
Chemiker erforschen vielfältige Stoffklasse für biologische und pharmazeutische Anwendungen
Anzeigen
Annette Rompel und ihr Team vom Institut für Biophysikalische Chemie der Universität Wien erforschen so genannte Polyoxometallate. Diese weisen eine große Vielfalt auf und bieten den Wissenschaftern damit ein breites Spektrum an Anwendungsmöglichkeiten. In Wechselwirkung mit Enzymen können sie die Kristallisation von Proteinen ermöglichen. Andererseits stellen die Polyoxometallate selber Verbindungen mit großem Anwendungspotential in der Katalyse und den Materialwissenschaften dar.
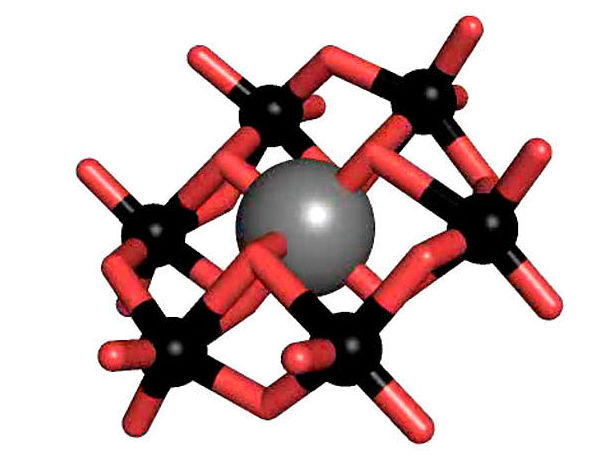
Das Tellur-haltige Anderson-Evans-Poyoxowolframate (grau: Tellur; rot: Sauerstoff, schwarz: Wolfram).
Annette Rompel
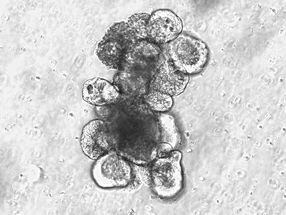
Ein Proteinkristall entsteht durch Wechselwirkungen mit dem Anderson-Evans-Polyoxometallate: TEW.
Annette Rompel
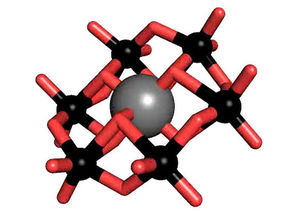

Polyoxometallate (POM) sind eine Stoffklasse bestehend aus anionischen Metalloxidclustern, die eine große strukturelle Vielfalt aufweisen, herausragende Eigenschaften besitzen und deshalb auch ein breites Spektrum an Anwendungsmöglichkeiten bieten. Eine der prominentesten POM-Strukturen ist die so genannte Anderson-Evans-Struktur, die von Rompels Arbeitsgruppe intensiv untersucht wird. Dazu gehört das Tellur-haltige Anderson-Polyoxowolframat (TEW), das Rompel erstmals als erfolgreichen Zusatzstoff in der Proteinkristallisation eingesetzt hat.
"Um die Wechselwirkung zwischen einem Protein und TEW zu verstehen, haben wir versucht, Proteinkristalle in Anwesenheit von TEW und auch ohne das TEW zu erhalten", erklärt Rompel. Dies ist für das Enzym Auronsynthase gelungen. Dabei wurde eine neuartige Struktur erzielt, die erstmals eine Bindung zwischen dem TEW und dem Protein aufweist. Das Kristallisationsadditiv war flexibel und konnte sich den Gegebenheiten im Protein anpassen, was TEW als Zusatzstoff in der Proteinkristallisation besonders wertvoll macht. Mittlerweile ist es Annette Rompel gelungen, drei verschiedene Proteine mit Hilfe von TEW zu kristallisieren.
Darüber hinaus versucht die Chemikerin nun, funktionelle Gruppen an die Anderson-Grundstruktur zu knüpfen – mit dem Ziel, neue Materialien herzustellen. "Nach der Funktionalisierung des ersten Anderson-Polyoxowolframates wird es nun möglich sein, neuartige funktionale Materialien herzustellen", so Rompel weiter.
Neben chemischen Anwendungen sind Rompels Erkenntnisse von hoher Relevanz für biologische, biochemische, medizinische und pharmazeutische Studien. Protein-Kristallographie stellt gegenwärtig die produktivste und am weitesten verbreitete Methode dar, um strukturelle Informationen über Proteine zu erhalten. Die strukturellen Erkenntnisse sind wichtig für das Verständnis der Proteinfunktion, aber auch für die Entwicklung von Protein-Liganden-Molekülen, was kleine organische Stoffe und auch größere Moleküle wie Antikörper sein können, die die Proteinfunktion beeinflussen. "Unsere Untersuchungen zeigen die Bedeutung von TEW als Zusatzstoff in der Proteinkristallisation auf. Unsere vorgeschlagene Synthesestrategie öffnet einen Weg für neue multifunktionale organisch-anorganischen Hybridmaterialien", schließt Annette Rompel.