Unerwartete Verbindung zwischen den häufigsten Krebstreibern könnte zu wirksameren Medikamenten führen
Möglicherweise ein sehr wirksamer Doppelschlag gegen Krebszellen
Anzeigen
Zwei der häufigsten genetischen Veränderungen, die Zellen zur Krebsentstehung veranlassen und von denen man bisher annahm, dass sie getrennt sind und durch unterschiedliche zelluläre Signale reguliert werden, arbeiten nach neuen Forschungsergebnissen der Universität von Wisconsin-Madison zusammen.
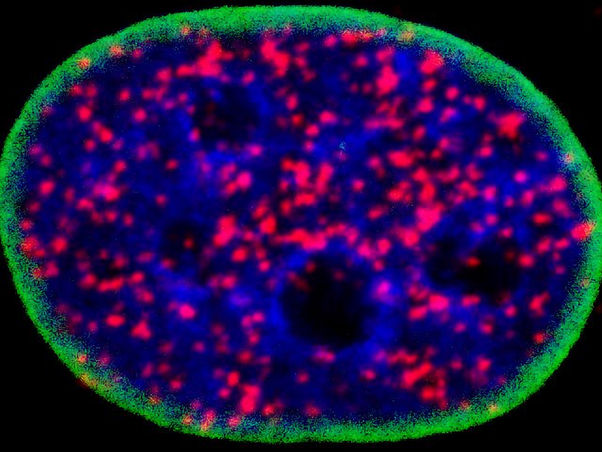
Dieser grün umrandete Kern einer Krebszelle enthält blaue DNA und rote Kleckse, die das p53-Protein der Zelle markieren, das sich mit Teilen des zellulären Atk-Signalwegs verbindet - eine Partnerschaft, die die Krebszelle daran hindert, so abzusterben, wie sie sollte, und stattdessen ihr Leben verlängert und sie dazu bringt, sich in weitere Krebszellen zu teilen.
Image by Mo Chen
Bislang haben sich die Forscher darauf konzentriert, Medikamente zu finden, die das eine oder das andere blockieren, um Krebs zu behandeln. Das Verständnis ihrer gemeinsamen Wirkung könnte zu wirksameren Behandlungen führen.
Zellen verfügen über ein Protein namens p53, das im Zellkern auf Stress reagiert. Mutationen des Gens, das p53 produziert, sind jedoch die häufigsten genetischen Anomalien bei Krebs. Mutationen, die einen zellulären Signalweg namens PI3K/Akt aktivieren, der sich auf der Oberfläche der Zellen befindet, sind ebenfalls häufig an einem unkontrollierten Zellwachstum bei Krebs beteiligt.
Zelluläre Signalwege ermöglichen es den Zellen, wichtige Kommunikationsaufgaben zu erfüllen, die gesunde Zellfunktionen aufrechterhalten. Der Prozess ist vergleichbar mit dem Versand von Post, der eine Reihe von Schritten und entsprechende Briefmarken und Markierungen auf dem Umschlag erfordert, um einen Brief an die richtige Adresse zu liefern.
Ein Team um die UW-Madison-Krebsforscher Richard A. Anderson und Vincent Cryns hat eine direkte Verbindung zwischen den p53- und PI3K/Akt-Signalwegen entdeckt. Die Ergebnisse, die in der Fachzeitschrift Nature Cell Biology veröffentlicht wurden, zeigen Verbindungen zwischen den Wegen auf, die vielversprechende Ziele für neue Krebsbehandlungen darstellen.
"Wir wissen schon seit einiger Zeit, dass Lipid-Botenmoleküle, die den PI3K/Akt-Signalweg in den Membranen aktivieren, auch im Zellkern vorhanden sind", sagt Anderson, Professor an der UW School of Medicine and Public Health. "Aber was sie im Zellkern abseits der Membranen tun, war ein Rätsel."
Mo Chen, eine assoziierte Wissenschaftlerin und Erstautorin der neuen Studie, setzte Krebszellen mit Chemotherapeutika unter Stress und schädigte ihre DNA, während sie sich replizierten oder neue Kopien von sich selbst erstellten (was Krebszellen häufig tun). Sie entdeckte, dass Proteine, so genannte Enzyme, die Teil des PI3K/Akt-Wegs sind, an das mutierte p53-Protein im Zellkern binden und Lipid-Botenstoffe an p53 anhängen, was zeigt, dass die beiden direkt miteinander verbunden sind.
Anstatt in die Apoptose einzutreten - den proaktiven Prozess des Zellselbstmords, der geschädigte Zellen beseitigt - reparierten die Krebszellen ihre durch die Chemotherapie geschädigte DNA und wuchsen und teilten sich weiter, was das Krebswachstum förderte.
"Unsere Entdeckung, dass der PI3K/Akt-Signalweg an p53 im Zellkern verankert ist, war völlig unerwartet", sagt Cryns, Arzt und Wissenschaftler sowie Professor an der UW School of Medicine and Public Health.
Man ging davon aus, dass der PI3K/Akt-Signalweg auf die Membranen beschränkt ist.
"Diese Ergebnisse haben auch entscheidende Auswirkungen auf die Krebsbehandlung", sagt Cryns. Derzeitige Behandlungen, die auf PI3K abzielen, funktionieren möglicherweise nicht, weil sie auf ein anderes Enzym wirken als das, das in dem vom Forschungsteam entdeckten Signalweg enthalten ist.
Das Enzym in dem neuen Signalweg heißt IPMK, und wenn man es inaktiviert, verhindert man, dass sich p53-Proteine mit dem Atk-Signalweg verbinden und ihn aktivieren, so wie man die Adresse auf einem Briefumschlag korrigiert, damit er nicht an die falsche Adresse geht. Dadurch wird verhindert, dass der Signalweg Krebszellen begünstigt, was IPMK zu einem vielversprechenden neuen Angriffspunkt für Medikamente macht.
Die Forscher, deren Arbeit von den National Institutes of Health, dem Verteidigungsministerium und der Breast Cancer Research Foundation unterstützt wird, haben außerdem ein weiteres Enzym mit der Bezeichnung PIPKIa identifiziert, das ein wichtiger Regulator sowohl für die Aktivierung von p53 als auch von Akt im Zellkern ist.
Das Team hatte zuvor gezeigt, dass PIPKIa das p53-Protein stabilisiert, so dass es aktiv werden kann. Wenn PIPKIa ausgeschaltet wurde, sank der p53-Spiegel in der Zelle stark ab. In der neuen Studie zeigte das Team, dass die Blockierung von PIPKIa durch genetische Ansätze oder ein Medikament den Tod von Krebszellen auslöst, indem p53 daran gehindert wird, Akt im Zellkern zu aktivieren.
"Das bedeutet, dass medikamentöse Inhibitoren von PIPKIa den Gehalt an mutiertem p53 reduzieren und die Aktivierung von Akt im Zellkern blockieren können, was ein sehr wirkungsvoller Doppelschlag gegen Krebszellen sein könnte", sagt Cryns. Ihr Team ist aktiv auf der Suche nach besseren PIPKIa-Inhibitoren, die zur Behandlung von Krebserkrankungen mit p53-Mutationen oder einem abnormal aktiven PI3K/Akt-Signalweg eingesetzt werden könnten.
Neben der Suche nach Medikamenten, die den neu entdeckten Krebsweg blockieren, untersuchen die Wissenschaftler auch, ob andere Proteine im Zellkern Ziele des PI3K/Akt-Weges sind.
"Wir wissen, dass andere Kernproteine durch Lipid-Botenstoffe wie p53 verändert werden, aber wir haben keine Ahnung, wie breit die Landschaft ist", sagt Anderson.
Die Erkenntnisse deuten jedoch darauf hin, dass dies ein gemeinsames Merkmal vieler Krebsarten sein könnte, "ein Mechanismus, den wir einen dritten Botenstoffweg nennen", fügt er hinzu.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.




















































