Hemmstoff im Tunnel
Neuer Ansatz zur Entwicklung von Cholin-Acetyltransferase-Inhibitoren
Anzeigen
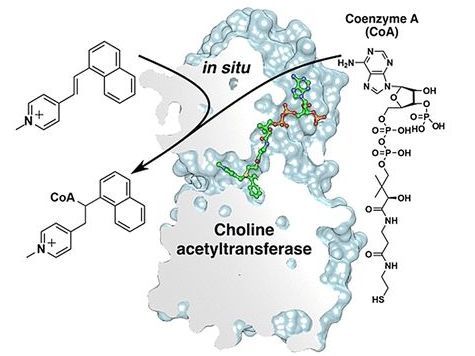
Das Enzym Cholin-Acetyltransferase (ChAT) katalysiert die Synthese des Neurotransmitters Acetylcholin und könnte ein Zielmolekül für Pharmaka sein. Ein schwedisches Forschungsteam hat jetzt den Wirkmechanismus von Arylvinylpyridinium (AVP), einer bekannten Klasse von Inhibitoren der ChAT, aufgeklärt. Wie sie in der Zeitschrift Angewandte Chemie berichten, baut die ChAT dabei den eigentlichen Wirkstoff selbst zusammen, indem es Coenzym A (CoA) an AVP knüpft.
© Wiley-VCH
Acetylcholin leitet u.a. Nervenimpulse in Synapsen weiter. Veränderungen der Menge oder Aktivität der ChAT, die Acetylcholin ausgehend von Cholin und Acetylcoenzym A (AcCoA) herstellt, wurden bei verschiedenen Krankheiten beobachtet, wie Morbus Alzheimer, Schizophrenie, angeborenen Störungen der Signalübertragung zwischen Nerven und Muskeln sowie chronischen viralen Infektionen. Eine Hemmung der ChAT könnte zudem eine wirksame Therapie bei Vergiftungen mit Organophosphat-Nervengiften darstellen.
Bisher fehlte es jedoch an geeigneten Inhibitoren für die ChAT. In vitro zeigten Arylvinylpyridinium-Verbindungen (AVPs) zwar eine durchaus gute Hemmung, ihr pharmakologisches Profil erwies sich dagegen als widersprüchlich. Das Team von der Swedish Defence Research Agency und der Universität Umeå (Schweden) um Fredrik Ekström konnte jetzt den Inhibierungsmechanismus von AVPs aufklären und so Erkenntnisse liefern, auf deren Basis sich ChAT-Inhibitoren mit verbesserter Wirksamkeit und Bioaktivität entwickeln lassen könnten.
Die Forscher konnten zeigen, dass der eigentliche bioaktive Wirkstoff nicht die AVPs selber sind, sondern deren Addukt mit CoA. Die Verknüpfung der beiden Bausteine nimmt die ChAT dabei selber vor – das Enzym baut also seinen eigenen Hemmstoff zusammen, ausgehend von einer exogenen Vorstufe (AVP) und einem endogen produzierten Co-Substrat (CoA). Bei der Reaktion handelt es sich um eine ungewöhnliche Hydrothiolierung, bei der eine Bindung zwischen der Thiol-Gruppe des CoA und der Vinyl-Gruppe des AVP geknüpft wird.
Die bindenden und katalytischen Domänen der ChAT bilden einen schmalen „Tunnel“, der sich quer durch das Enzym zieht. Röntgenkristallographische Analysen von menschlicher ChAT in Anwesenheit von CoA und AVP ergaben, dass das inhibierende Addukt tief in diesen Tunnel eingebettet ist. Wechselwirkungen mit hydrophoben Taschen nahe der Cholin-Bindestelle haben dabei erheblich Auswirkungen auf die Stärke von ChAT-Inhibitoren.
Die Forscher hoffen, dass sich ausgehend von ihren Erkenntnissen neuartige ChAT-Inhibitoren mit verbesserter Wirksamkeit und Wirkdauer entwickeln lassen.






















































