Induziert-pluripotente Stammzellen für die Erforschung von HIV und angeborener Immunantwort
Anzeigen
Wissenschaftlerinnen des Paul-Ehrlich-Instituts haben mit Forschern aus Deutschland und Frankreich induzierte pluripotente Stammzellen (iPSCs) eines Gesunden, eines Patienten mit Aicardi-Goutières-Syndrom und eines Patienten mit Renpenning-Syndrom erzeugt. Bei den genannten Krankheiten spielen Proteine eine Rolle, die auch für die immunologische Erkennung des Humanen Immundefizienz-Virus (HIV) wichtig sind. Mit iPSCs und abgeleiteten Zelltypen lassen sich neue Erkenntnisse über die Syndrome sowie das menschliche Immunsystem im Kampf gegen HIV gewinnen.
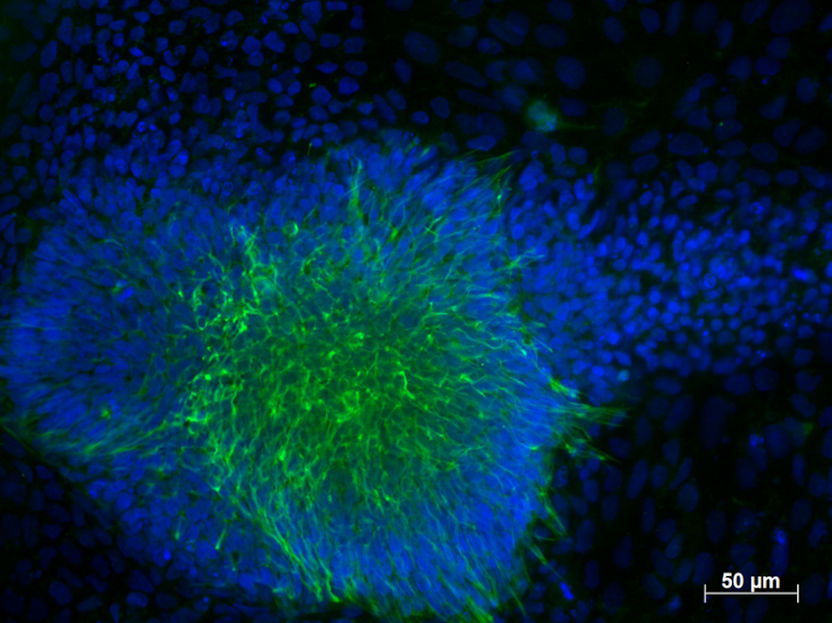
Fluoreszenzmikroskopische Aufnahme induzierter pluripotenter Stammzellen eines gesunden Blutspenders differenziert zu frühem Ektoderm.
Paul-Ehrlich-Institut
Die biologischen Prozesse im menschlichen Körper sind komplex – entsprechend anspruchsvoll ist das Entschlüsseln krankheitsauslösender Prozesse. Krankheiten, an denen das Immunsystem beteiligt ist, sind häufig schwer zu erforschen. Eine wichtige Methode, um die Ursachen aufzuklären, ist der Vergleich gesunder und kranker Zellen. Zu diesem Zweck haben Forscher des Paul-Ehrlich-Instituts, Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, sogenannte induzierte pluripotente Stammzelllinien (iPSCs) von einer gesunden Person sowie von zwei Patienten mit zwei unterschiedlichen, genetisch bedingten Krankheiten erzeugt. iPSCs sind Multitalente, weil sie sich in ganz unterschiedliche Zelltypen weiterentwickeln können. Sie sind damit ein nützliches Werkzeug, um zelluläre Prozesse bei Gesunden und Kranken zu untersuchen.
Der eine Patient, von dem die PEI-Forschern um Dr. Renate König, Leiterin des Fachgebiets „Zelluläre Aspekte von Pathogen-Wirt-Interaktionen“, iPSCs erzeugt haben, leidet unter dem Renpenning-Syndrom. Dies ist eine seltene angeborene X-chromosomale Erkrankung, die mit mentaler Retardierung, Mikrozephalie, Kleinwuchs und Hypogonadismus einhergeht. Mutationen im Polyglutamin-Bindungsprotein 1 (PQBP1) sind die Ursache für diese Erkrankung. Der zweite Patient leidet am Aicardi-Goutières-Syndrom (AGS). AGS-Patienten zeigen variable klinische Manifestationen einschließlich intrakranieller Verkalkung, Hirnatrophie, Anomalien der weißen Hirnsubstanz sowie eine krankhafte Vermehrung der weißen Blutkörperchen (Leukozytose) und eine Hochregulation der Bildung von Typ-I-Interferonen. Die Typ-I-Interferone haben eine immunstimulierende und u.a. antivirale Wirkung und gehören zu den Zytokinen. Sieben Gene wurden mit dem AGS assoziiert, darunter das Gen für den Restriktionsfaktor SAMHD1 (sterile alpha motif and histidine-aspartate (HD)-domain-containing protein 1). Restriktionsfaktoren hemmen in Körperzellen die Virusinfektion und -vermehrung (Replikation) und in diesem Fall auch die Immunerkennung von HIV-1.
Warum interessieren sich die Wissenschaftler genau für diese beiden Erkrankungen? Bei beiden Erkrankungen ist das Immunsystem beteiligt. Zudem sind SAMHD1 und PQBP1 nicht nur von Bedeutung für die genannten Erkrankungen, sondern spielen auch eine wichtige Rolle für die Immunerkennung von HIV, dem humanen Immundefizienz-Virus. HIV ist ein Forschungsschwerpunkt der PEI-Arbeitsgruppe, die sich die Erforschung der Interaktionen zwischen dem Erreger und den Wirtszellen zur Aufgabe gemacht hat.
„Die induzierten pluripotenten Stammzellen wollen wir nutzen, um weiter aufzuklären, wie HIV vom angeborenen Immunsystem erkannt wird. Gleichzeitig erforschen wir die Ursachen dieser beiden Erkrankungen, deren Schlüssel sich im angeborenen Immunsystem zu verbergen scheint“, erläutert König die Motivation für die Forschungsaktivitäten. Weitere Erkenntnisse über das angeborene Immunsystem könnten auch nützlich sein für das Design neuer Impfstoffe.
Originalveröffentlichung
Fuchs NV, Schieck M, Neuenkirch M, Tondera C, Schmitz H, des Portes V, Germanaud D, Steinemann D, Göhring G, König R; "Induced pluripotent stem cells (iPSCs) derived from a renpenning Syndrome patient with c.459_462delAGAG mutation in PQBP1 (PEIi001-A)"; Stem Cell Res. 2019 Dec;41:101592.
Fuchs NV, Schieck M, Neuenkirch M, Tondera C, Schmitz H, Steinemann D, Göhring G, König R; "Induced pluripotent stem cell line (PEIi003-A) derived from an apparently healthy male individual"; Stem Cell Res. 2019 Dec 4;42:101679.
Fuchs NV, Schieck M, Neuenkirch M, Tondera C, Schmitz H, Wendeburg L, Steinemann D, Elpers C, Rutsch F, König R.; "Generation of three induced pluripotent cell lines (iPSCs) from an Aicardi-Goutières syndrome (AGS) patient harboring a deletion in the genomic locus of the sterile alpha motif and HD domain containing protein 1 (SAMHD1)"; Stem Cell Res 2020 Jan 9; [epub ahead of print].























































