Dynamik der wichtigsten viralen Angriffsstrategie erstmals sichtbar
Visualisierung und Quantifizierung von Frameshifting-Mechanismen in lebenden Zellen
Anzeigen
Viele infektiöse Viren, von HIV bis West-Nil, verlassen sich auf einen grundlegenden biologischen Prozess namens Frameshifting, um ihren Angriff zu maximieren. Lange Zeit als Schlüsselmechanismus identifiziert, mit dem sich Viren in ihren Hosts vermehren, war die Echtzeitdynamik des Frameshifting bisher noch nie direkt beobachtet worden.

Ribosomen (Züge) Frameshift (Wechselspuren) in der HIV-1 Frameshift-Sequenz (gelbes Zeichen), die im Vergleich zu nicht rahmenversetztem Protein (grüner Rauch) große Mengen an rahmenversetztem Protein (blauer Rauch) produzieren.
Keith Rein/Salt & Paper House
Zum ersten Mal haben die Wissenschaftler der Colorado State University, Tim Stasevich und Brian Munsky, detaillierte Bildgebungstechnologien und Berechnungsanalysen entwickelt, um Frameshifting-Mechanismen auf der Ebene einzelner Moleküle in lebenden Zellen zu visualisieren, zu quantifizieren und zu verstehen.
"Wir hoffen, dass diese integrierten experimentellen und computergestützten Methoden, die es uns ermöglichen, einzigartige Aspekte der Virusreplikation zu beobachten und vorherzusagen, Strategien für zukünftige antivirale Therapien bieten können", sagt Stasevich, Monfort Professor und Assistenzprofessor am Department für Biochemie und Molekularbiologie.
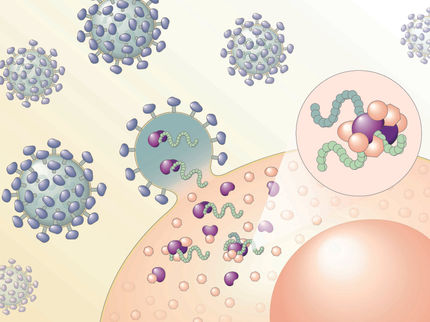
HIV ist ein Beispiel für ein Retrovirus, d.h. es trägt genetische Informationen in einem Molekül namens RNA und nicht in der DNA. Wenn ein Virus eine Wirtszelle infiziert, stellt es virale Proteine durch die Manipulation von Ribosomen her, den zellulären Proteinsynthesemaschinen, in denen genetische Anweisungen von RNA in Proteine umgewandelt oder übersetzt werden. Während des Frameshiftings "rutscht" ein Ribosom, das eine RNA übersetzt, um einen Punkt rückwärts oder vorwärts entlang einer Nukleotidsequenz, was zur Übersetzung einer völlig anderen Proteinsequenz führt, die sich vorwärts bewegt. Dieser Prozess vernetzt im Wesentlichen zwei Proteine zum Preis einer RNA und ermöglicht es Viren, ihr Genom effizient kompakt zu halten.
Stasevich war ein Pionier in der molekularen Bildgebung und verwendete dafür proteinbasierte Tags, die selektiv in verschiedenen Farben binden und fluoreszieren, wenn beispielsweise die RNA-Translation stattfindet. Sein Labor hat empfindliche Mikroskope entwickelt, die diese Bindungsvorgänge in Echtzeit erfassen und Filme über bisher unsichtbare Prozesse machen. Munsky, ehemaliger Richard P. Feynman Fellow am Los Alamos National Laboratory und Assistenzprofessor am Department of Chemical and Biological Engineering, ist Experte für den Aufbau von Berechnungsmodellen zum Durchsuchen verrauschter oder "stochastischer" Einzelmoleküldaten, um statistische Signaturen verborgener biophysikalischer Mechanismen zu finden.
In diesem neuesten Experiment überwachte Stasevichs Team gleichzeitig die Übersetzung einzelner RNAs in zwei einzigartige Proteinketten während der Frameshifting unter Verwendung der Bindungsfragmente des HIV-1-Virus (nicht des gesamten Virus).
Wenn man in diese verborgene Welt blickt, könnte das, was das Team sah, einige Biologen überraschen.
Sie fanden heraus, dass Frameshifting nach einer längeren Zeit des Nicht-Frameshifting in Aktivitätsausbrüchen auftritt.
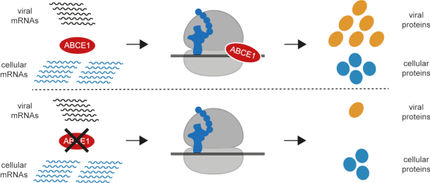
Es war bisher bekannt, dass beispielsweise das HIV-Virus in etwa 5 Prozent der Zeit durch Frameshifting erzeugte Proteine ausgibt. Aber statt vieler RNAs Frameshifting auf einmal beobachteten die Forscher eine Teilmenge von RNAs Frameshifting wie verrückt, wobei etwa 5 Prozent der RNAs das gesamte Frameshifting durchführten, während 100 Prozent der RNAs Frameshifting-Aufgaben teilten. Dies zeigt, dass Frameshifting nur in einer kleinen Teilmenge der RNA stattfindet.
Es bleibt unklar, was diese frameshifting RNA genau von anderen unterscheidet, sagen die Forscher. Aber ihre neu entdeckte Fähigkeit, diese spezielle Untergruppe der viralen RNA anzugreifen, verspricht eine neue Tiefe im Verständnis der viralen Replikation und könnte eines Tages neue antivirale Therapeutika informieren.
Munskys Modellierungsgruppe stellte alle Frameshifting-Beobachtungen des Stasevicher Labors durch detaillierte Computersimulationen des Ribosomenverkehrs entlang von RNA-Molekülen nach. Aguilera und Munsky zeigten, dass zeitliche Schwankungen der Fluoreszenzdaten nur reproduziert werden konnten, wenn Ribosomen, die am viralen Frameshifting beteiligt waren, manchmal an der Frameshift-Stelle pausieren. Ihre Modelle schlugen vor, dass diese Pausen zu ribosomalen "Staus" führen würden, die die Produktion von rahmenverschobenen Proteinen lange nach Beendigung der regulären Übersetzung aufrechterhalten. Die Modelle prognostizierten und validierten bildgebende Experimente, dass das Verschieben der Frameshift-Stelle in die Mitte der RNA zu größeren "Staus" führte.
Das nächste Ziel der Forscher ist es, viel mehr - vielleicht Hunderte - verschiedener RNA- und Proteinmoleküle gleichzeitig zu visualisieren, jeweils mit einem eigenen Fingerabdruck von Farbe, Helligkeitsmuster oder Fluktuationsgeschwindigkeit. Diese und andere statistische Signaturen können durch die kontinuierliche enge Integration von Einzelmolekül-Imaging und Computermodellierung visualisiert und quantifiziert werden.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.