Der Nitrogenase auf der Spur
Entscheidender Schritt zum Verständnis der biologischen Stickstofffixierung
Anzeigen
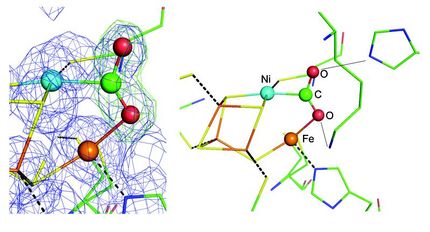
Die molekularen Mechanismen der biologischen Fixierung von Stickstoff durch das Enzym Nitrogenase sind ein Stück weiter aufgeklärt: Dr. Daniel Sippel aus der Arbeitsgruppe von Prof. Dr. Oliver Einsle am Institut für Biochemie der Universität Freiburg hat gezeigt, dass der Eisen-Vanadium-Cofaktor (FeVco) des Enzyms ein einzelnes Schwefelion abgeben und wieder binden kann. Die Freiburger Forscherinnen und Forscher konnten bereits zuvor teilweise das Zentrum einer anderen Nitrogenase, den Eisen-Molybdän-Cofaktor (FeMoco), analysieren. Um dessen Reaktionen noch besser zu verstehen, untersuchte Schiller eine besondere Variante des Enzyms, die statt Molybdän das Element Vanadium enthält, was zu einer Reihe leicht veränderter chemischer Eigenschaften führt. Wenn FeVco das Schwefelion abgibt, wird die Bindestelle für Stickstoff freigelegt. Zwei Aminosäuren, als Teile des Proteins, stehen dann bereit, um die für die Reaktion benötigten Protonen zu liefern und die umgesetzte Stickstoffverbindung präzise am Platz zu halten.
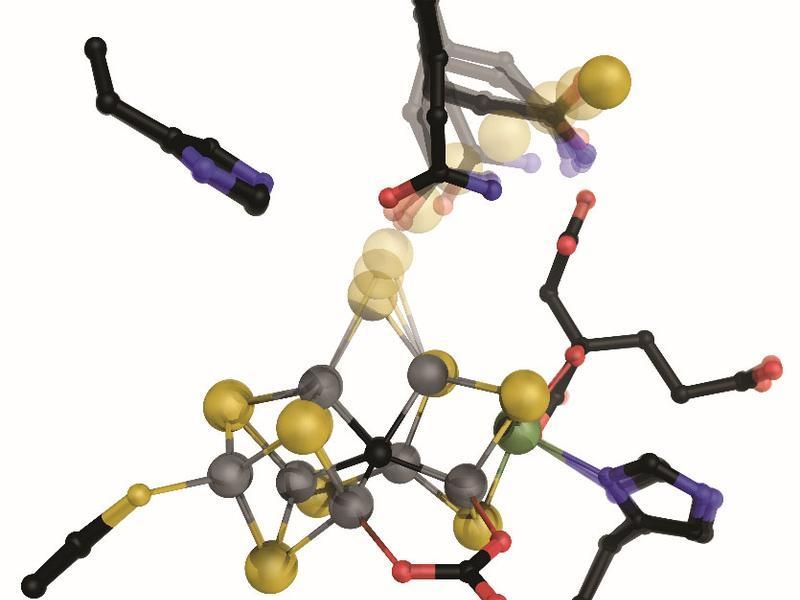
Im aktiven Zentrum der vanadiumhaltigen Nitrogenase sitzt ein Metallzentrum, aus dem nach Aktivierung ein Schwefelion (gelb) entfernt wird, sodass eine Bindestelle für Stickstoff an zwei der sieben Eisenionen (grau) freigelegt wird.
Oliver Einsle
Die Arbeitsgruppe beschäftigt sich seit langer Zeit mit der Nitrogenase mit dem Ziel, sie biotechnologisch nutzbar zu machen. Dadurch könnte sie eine Alternative zu großtechnischen chemischen Düngemethoden wie dem Haber-Bosch-Verfahren, das Stickstoff mit Wasserstoff zu Ammoniak verbindet, bieten. In der Natur bewerkstelligt Nitrogenase als einziges Enzym die gleiche Reaktion, ohne jedoch überschüssige Stickstoffverbindungen in die Umwelt abzugeben. Allerdings ist die Funktion dieses komplexen, metallhaltigen Enzymsystems bislang nur unvollständig geklärt. Die gewonnenen Informationen von Sippel bilden eine neue Grundlage für das Verständnis der molekularen Mechanismen der Stickstofffixierung. Dadurch ist es den Forschenden möglich, eine Vielzahl angesammelter Daten besser zu verstehen und in ein Gesamtbild der Reaktion dieses Enzyms zu integrieren.