Enzym aus Algen bildet den Kraftstoff von morgen
Entdeckung ebnet den Weg für optimierte Hydrogenasen
Anzeigen
Von einer mikroskopisch kleinen Grünalge wollen sich Forscher "eine Scheibe abschneiden": Hocheffizient und ohne Treibhausgasemission kann eines ihrer Enzyme molekularen Wasserstoff produzieren. Einen Haken hat die Sache aber: Das Ganze funktioniert nur unter Ausschluss von Sauerstoff. Kommt Luft ins Spiel, geht die Wasserstofffabrik sofort und endgültig zugrunde, was die großtechnische Nutzung des Enzyms erschwert. Warum Sauerstoff so zerstörerisch wirkt, haben Bochumer Biologen um Prof. Dr. Thomas Happe gemeinsam mit Kollegen aus Oxford und Berlin auf molekularer Ebene untersucht. Ergebnis: Sauerstoffatome docken am selben Bindungsort an wie das eigentliche Substrat, der Wasserstoff. Durch Elektronenübertragung entstehen aggressive Sauerstoffformen, die Teile des Enzymkerns attackieren. Ziel der Forscher ist es jetzt, das Enzym gegen Sauerstoff unempfindlich zu machen. Sie berichten in den Proceedings of the National Academy of Science (PNAS) und im Journal of the American Chemical Society (JACS).
Hydrogenasen, wirken als Katalysatoren und können aus Elektronen und Protonen molekularen Wasserstoff herstellen. Ein Protein kann bis zu 9.000 Moleküle Wasserstoff pro Sekunde produzieren. Diese Hydrogenasen kommen auch in Grünalgen vor, die mittels Energie aus Sonnenlicht Wasser zu Sauerstoff, Protonen (H+) und Elektronen (e-) spalten können. Dank der Hydrogenase haben die Grünalgen u. a. die Möglichkeit, überschüssige Energie in Form von Elektronen auf Protonen zu übertragen, wobei Wasserstoff entsteht. In der Arbeitsgruppe Photobiotechnologie am Lehrstuhl Biochemie der Pflanzen erforscht Prof. Dr. Thomas Happe die Zusammenhänge von Photosynthese und Wasserstoffproduktion am Beispiel der einzelligen Grünalge Chlamydomonas reinhardtii. Diese photosynthetisch aktiven Algen geben unter Schwefelmangelbedingungen große Mengen Wasserstoff an ihre Umgebung ab. Seit dieser Entdeckung im Jahr 2000 gilt die photobiologische Wasserstoffproduktion als viel versprechende Möglichkeit zur Herstellung von umweltfreundlichem Wasserstoff.
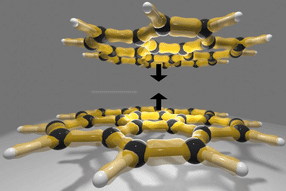
Die AG Photobiotechnologie arbeitet an der biochemischen und biophysikalischen Charakterisierung der für die Wasserstoffproduktion verantwortlichen Enzyme. Die Hydrogenasen verfügen über einen besonderen Eisen-Schwefel-Kern (der so genannte H-Kluster), an dem die Bildung von Wasserstoffgas mit extrem hoher Geschwindigkeit katalysiert wird. Der H-Kluster besteht aus einem Kern aus vier Eisen- und vier Schwefelatomen (4Fe-4S-Kern), der über eine Schwefelverbindung an ein weiteres Kluster mit zwei Eisen- und zwei Schwefelatomen (2Fe-2S-Kluster) gebunden ist. Dieses Subkluster besitzt ungewöhnliche Kohlenstoffmonoxid- und Cyanid-Liganden und ist der Bindungsort für den Wasserstoff.
"Da es für die Nutzung der Hydrogenasen als biologische Katalysatoren zur Produktion von Wasserstoff gilt, ihre extreme Sauerstoffempfindlichkeit zu überwinden, fragen wir uns: Warum werden alle Hydrogenasen so schnell und irreversibel durch Luftsauerstoff inaktiviert?", erklärt Prof. Happe. In enger Zusammenarbeit mit Kollegen aus Oxford und Berlin gelang es ihm und seinem Doktoranden Sven Stripp nun, den Mechanismus der Inaktivierung der Enzyme auf atomarer Ebene aufzuklären. Mit Hilfe modernster biophysikalischer Methoden wie Proteinfilm-Elektrochemie und Röntgenabsorptionsspektroskopie fanden die Forscher heraus, dass das Sauerstoff-Molekül genau wie das eigentliche Substrat, der Wasserstoff, an das 2Fe-2S-Kluster gebunden wird. Allerdings geht die zerstörerische Wirkung des Sauerstoff-Moleküls offenbar nicht direkt von seiner Bindung an dieses Kluster aus. Vielmehr konnten die Forscher zeigen, dass das weiter entfernte 4Fe-4S-Cluster kurz nach der Bindung des O2-Moleküls nicht mehr nachweisbar ist, also zerstört wird. Die Wissenschaftler postulieren, dass durch eine Übertragung von Elektronen auf den gebundenen Sauerstoff, aggressive "reaktive" Sauerstoffvarianten (reactive oxygen species) entstehen, die dann in einer zweiten Reaktion Teile des 4Fe-4S-Kluster attackieren, dem bis dato keine Relevanz für die Sauerstoffsensitivität der Hydrogenasen zugeschrieben wurde.
Diese Entdeckung ebnet den Weg für eine gezielte Modifikation der Hydrogenase, die sie gegenüber Luftsauerstoff unempfindlicher machen soll. "Wir arbeiten an einem viel versprechenden Ansatz, der die Prinzipien der "gerichteten Evolution" und des "Rationalen Protein Designs" kombiniert", so Prof. Happe. Die hierbei erzeugten Enzymvarianten werden mit einem einfachen Screening-Verfahren auf erhöhte Sauerstoff-Toleranz getestet. Auf das Arbeitsprogramm zugeschnitten wird weltweit erstmals unter Sauerstoffabschluss ein Roboter System installiert, das sowohl ein effizientes Screening der Enzymbibliotheken ermöglicht, als auch eine automatisierte Anzucht und Analyse von Kristallen sauerstoffsensibler Proteine gewährleistet, welche für die Strukturaufklärung der neuen Enzyme notwendig sind.
Originalveröffentlichungen: Sven T. Stripp, Gabrielle Goldet, Caterina Brandmayr, Oliver Sanganas, Kylie A. Vincent, Michael Haumann, Fraser A. Armstrong and Thomas Happe: "How oxygen attacks [FeFe] hydrogenases from photosynthetic organisms."; PNAS 2009 106:17331-17336.
Gabrielle Goldet, Caterina Brandmayr, Sven T. Stripp, Thomas Happe, Christine Cavazza, Juan C. Fontecilla-Camps and Fraser A. Armstrong: "Electrochemical Kinetic Investigations of the Reactions of [FeFe]-Hydrogenases with Carbon Monoxide and Oxygen: Comparing the Importance of Gas Tunnels and Active-Site Electronic/Redox Effects."; J. Am. Chem. Soc., 2009, 131 (41), pp 14979-14989.
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!