Quando i funghi prendono il respiro - Come una muffa può squilibrare i polmoni
L'infezione da Aspergillus fumigatus non modifica solo i polmoni, ma anche l'intestino e il metabolismo giocano un ruolo sorprendente
Annunci
Un intruso invisibile mette alla prova il delicato equilibrio dei nostri polmoni: la muffa Aspergillus fumigatus, innocua in natura, può diventare un serio pericolo se il sistema immunitario è indebolito - e modificare l'intero mondo batterico dei polmoni. Ma non solo: anche l'intestino e il metabolismo sembrano essere influenzati da un'infezione polmonare.
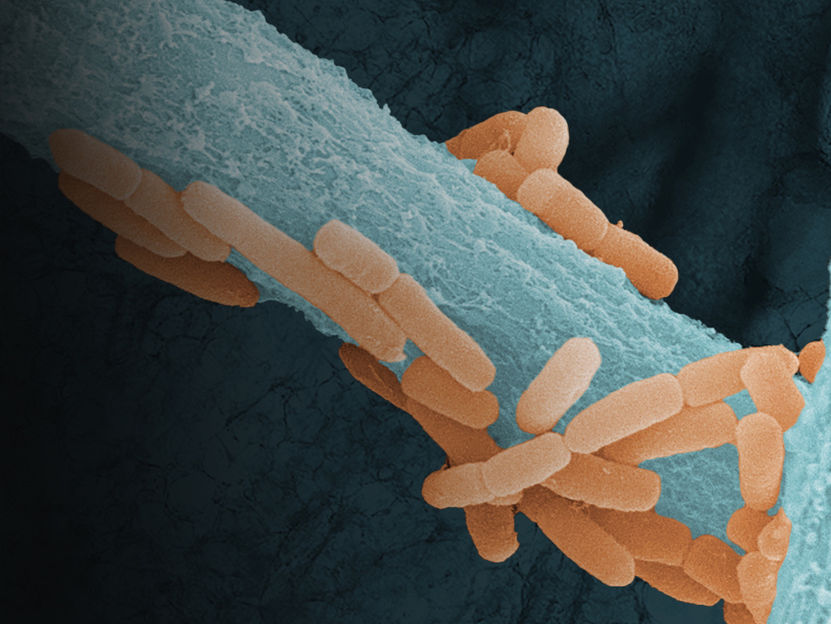
La crescita di 𝘓𝘪𝘨𝘪𝘭𝘢𝘤𝘵𝘰𝘣𝘢𝘤𝘪𝘭𝘭𝘶𝘴 𝘮𝘶𝘳𝘪𝘯𝘶𝘴 (arancione), un membro del microbioma polmonare murino, lungo le ife del fungo patogeno del polmone 𝘈𝘴𝘱𝘦𝘳𝘨𝘪𝘭𝘭𝘶𝘴 𝘧𝘶𝘮𝘪𝘨𝘢𝘵𝘶𝘴 (blu), con tessuto polmonare sullo sfondo. Immagine.
Liubov Nikitashina (Leibniz-HKI) and Sandor Nietzsche (EMZ-UKJ).
Un fungo che fa più del previsto
L'Aspergillus fumigatus si trova praticamente ovunque: nel terreno, nel compost o nell'aria. Di solito è innocuo per le persone sane. Tuttavia, nei pazienti con un sistema immunitario indebolito, può causare una grave infezione polmonare, nota come aspergillosi invasiva. Il fungo può potenzialmente alterare i livelli di ossigeno nei polmoni in misura tale da creare un ambiente più adatto a certi batteri - come il Ligilactobacillus murinus, tipicamente presente nell'intestino, nella cavità orale e nei polmoni dei topi - per sopravvivere meglio e potenzialmente prosperare. Questa interazione potrebbe influenzare la progressione della malattia e consentire nuove strategie terapeutiche.
Dai polmoni all'intestino: tutto è collegato
È noto da tempo che l'intestino e i polmoni sono strettamente collegati. I nuovi dati di un gruppo di ricerca di Jena hanno ora approfondito questa conoscenza. I ricercatori hanno trovato prove che non solo il microbioma polmonare, ma anche quello intestinale e alcuni prodotti metabolici nel sangue cambiano durante l'infezione dei polmoni con Aspergillus fumigatus. Questo cosiddetto "asse intestino-polmone" potrebbe svolgere un ruolo importante nelle terapie future. Il lavoro è stato realizzato da scienziati del Cluster of Excellence Balance of the Microverse, del Leibniz Institute for Natural Product Research and Infection Biology - Hans Knöll Institute (Leibniz-HKI) e della Friedrich-Schiller-University Jena ed è stato recentemente pubblicato sulla rivista Cell Reports.
Metodologia e risultati principali
Il team di ricerca ha utilizzato un modello murino di aspergillosi invasiva. Per scoprire come l'infezione influisce sui microbi nei polmoni e nell'intestino, i ricercatori hanno esaminato i marcatori genetici dei microrganismi. Per simulare le condizioni cliniche nel modo più realistico possibile, sono stati considerati anche gli effetti dell'immunosoppressione e del trattamento antimicotico con voriconazolo. Il team ha utilizzato metodi specializzati, tra cui il sequenziamento del DNA per identificare i batteri nei polmoni e nell'intestino e la PCR quantitativa per misurare la quantità del patogeno fungino Aspergillus fumigatus e del batterio dominante Ligilactobacillus murinus nei polmoni. Inoltre, sono state effettuate analisi metabolomiche del plasma e del tessuto polmonare. Queste analisi registrano e quantificano tutti i prodotti metabolici in un sistema biologico per comprendere i cambiamenti nel metabolismo. Inoltre, i ricercatori hanno isolato batteri vivi dalle vie aeree inferiori dei topi e li hanno messi in co-coltura con l'Aspergillus fumigatus per studiare le possibili interazioni. Uno dei risultati principali dello studio è che l'infezione fungina squilibra sia il microbioma polmonare che quello intestinale. Nei polmoni, ciò porta a un accumulo di batteri anaerobi. Particolarmente sorprendente è stata la crescita del Ligilactobacillus murinus, suggerendo che il fungo crea una nicchia microaerofila (basse concentrazioni di ossigeno) che favorisce questo batterio.
Limiti dello studio - cosa non ha (ancora) trovato risposta
L'analisi del microbioma polmonare è impegnativa perché la quantità di DNA batterico nel polmone è molto bassa e si sovrappone al DNA umano. "Anche se abbiamo analizzato numerosi campioni di controllo, i risultati potrebbero ancora includere alcuni errori di classificazione quando si tratta di batteri presenti in abbondanze estremamente basse", afferma Liubov Nikitashina, prima autrice dello studio. La bassa resa di DNA ha inoltre limitato l'identificazione dei batteri al livello di genere. Metodi migliori per l'estrazione del DNA batterico da siti corporei così scarsamente colonizzati potrebbero rendere gli studi futuri ancora più significativi.
Lo studio solleva importanti domande per la ricerca futura: Quale ruolo svolgono i batteri anaerobi come il Ligilactobacillus murinus nel modulare le infezioni da Aspergillus fumigatus? L'accumulo di questi batteri nei polmoni potrebbe servire come marcatore diagnostico o addirittura consentire nuovi approcci terapeutici?
Un piccolo fungo con un grande effetto
Le infezioni fungine sono un problema serio, soprattutto per le persone immunocompromesse o già gravemente malate, ad esempio in unità di terapia intensiva o affette da cancro. Le nuove scoperte forniscono importanti informazioni su come queste infezioni possano essere meglio comprese ed eventualmente prevenute. In futuro, potrebbe essere possibile influenzare in modo specifico il microbioma per sostenere l'organismo nella lotta contro il fungo o sviluppare nuovi farmaci mirati proprio a quest'area.
Il lavoro su questo progetto è stato finanziato dalla Fondazione tedesca per la ricerca, dal Ministero federale dell'Istruzione e della ricerca e dall'Unione europea.
Nota: questo articolo è stato tradotto utilizzando un sistema informatico senza intervento umano. LUMITOS offre queste traduzioni automatiche per presentare una gamma più ampia di notizie attuali. Poiché questo articolo è stato tradotto con traduzione automatica, è possibile che contenga errori di vocabolario, sintassi o grammatica. L'articolo originale in Inglese può essere trovato qui.
Pubblicazione originale
Liubov Nikitashina, Xiuqiang Chen, Lukas Radosa, Kexin Li, Maria Straßburger, Bastian Seelbinder, Wibke Böhnke, Sarah Vielreicher, Sandor Nietzsche, Thorsten Heinekamp, Ilse D. Jacobsen, Gianni Panagiotou, Axel A. Brakhage; "The murine lung microbiome is disbalanced by the human-pathogenic fungus Aspergillus fumigatus resulting in enrichment of anaerobic bacteria"; Cell Reports, Volume 44







































