Attirer le virus dans un piège
Des chercheurs décrivent des mécanismes qui pourraient contribuer à prévenir les infections par les virus de la grippe A et d'Ebola
Les virus tels que la grippe A et Ebola envahissent les cellules humaines en plusieurs étapes. Dans le cadre d'une approche interdisciplinaire, des équipes de recherche de l'université et de l'hôpital universitaire de Heidelberg ont étudié les étapes finales de la pénétration virale à l'aide de la tomographie électronique et de simulations informatiques. Dans le cas de la grippe A, elles ont pu déterminer comment le système immunitaire combat le virus à l'aide d'une petite protéine. Dans le cas du virus Ebola, ils ont découvert qu'une structure protéique spécifique doit être désassemblée pour qu'une infection puisse se développer. Les pores de fusion, par lesquels le génome viral est libéré dans la cellule hôte, jouent un rôle central dans ces processus. Si l'on peut empêcher leur formation, le virus est également bloqué. Les scientifiques de Heidelberg décrivent des mécanismes inconnus jusqu'à présent, qui pourraient conduire à de nouvelles approches pour prévenir les infections.
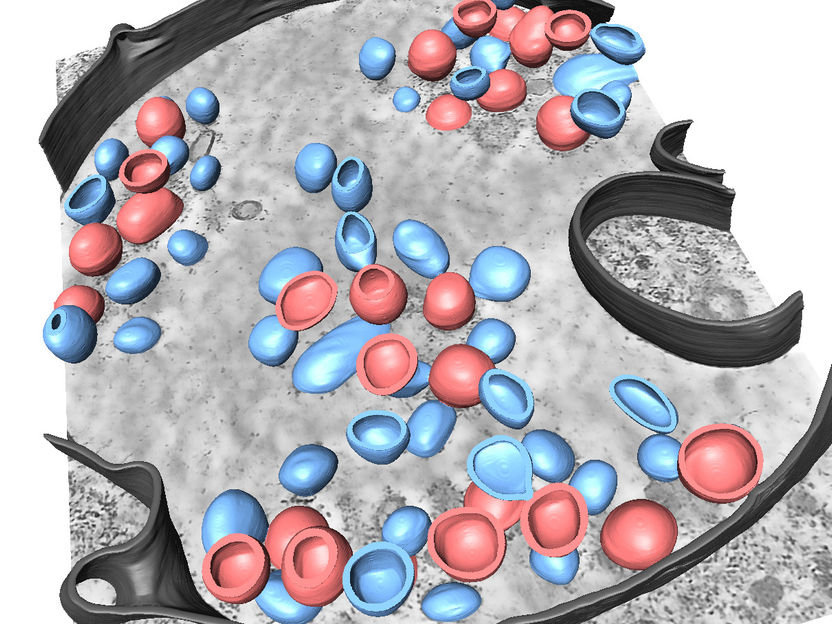
Segmentation en 3D de différentes structures liées à une infection par le virus de la grippe A.
Petr Chlanda
De nombreux virus qui infectent l'homme sont recouverts d'une membrane lipidique contenant des glycoprotéines qui peuvent s'arrimer aux cellules humaines. Dans le cas de virus comme celui de la grippe A, qui pénètre par les voies respiratoires, il s'agit des protéines de pointe qui se lient principalement aux cellules épithéliales du nez et des poumons. En revanche, le virus Ebola, hautement infectieux, se propage par contact direct avec des fluides corporels infectés et peut pénétrer dans un large éventail de types de cellules. Après avoir envahi les cellules humaines, ces virus doivent ouvrir un pore de fusion entre la membrane du virus et la membrane de l'hôte pour libérer leur génome dans la cellule hôte et se propager.
Pour combattre le virus, le système immunitaire humain tente de bloquer la formation du pore de fusion par un processus en plusieurs étapes. Les cellules infectées détectent la présence du génome étranger et envoient un signal, sous la forme d'une molécule d'interféron, aux cellules non encore infectées. Ce signal déclenche la production par les cellules non infectées d'une petite protéine cellulaire appelée protéine transmembranaire induite par l'interféron 3 (IFITM3). "Cette protéine spécialisée peut empêcher efficacement la pénétration de virus tels que la grippe A, le SRAS-CoV-2 et Ebola, mais les mécanismes sous-jacents étaient inconnus", explique le Dr Petr Chlanda, virologue, dont le groupe de travail appartient au BioQuant Center de l'université de Heidelberg et au Center for Integrative Infectious Disease Research de l'hôpital universitaire de Heidelberg. Les chercheurs ont pu démontrer que pour les virus de la grippe A, IFITM3 trie sélectivement les lipides de la membrane au niveau local. Cela empêche la formation des pores de fusion. "Les virus sont littéralement capturés dans un piège à lipides. Nos recherches indiquent qu'ils sont finalement détruits", explique le Dr Chlanda.
Pour analyser les détails structurels des virus, le Dr Chlanda et son équipe ont utilisé l'équipement du réseau de cryo-microscopie électronique de Ruperto Carola. Dans une approche interdisciplinaire, les groupes de recherche dirigés par le professeur Ulrich Schwarz du BioQuant-Center et de l'Institut de physique théorique, ainsi que par le professeur Walter Nickel du Centre de biochimie de l'Université de Heidelberg, ont prédit ce processus à l'aide de simulations informatiques. Dans le contexte de la thérapie antivirale, les chercheurs pensent qu'il est possible de développer des peptides de triage des lipides qui s'insèrent dans la membrane du virus, rendant les virus incapables de fusionner avec la membrane. "De tels peptides pourraient être utilisés dans un spray nasal, par exemple", précise Petr Chlanda.
Dans une seconde étude, les chercheurs de Heidelberg ont étudié la pénétration et la fusion du virus Ebola. La morphologie filamenteuse du virus est déterminée par une enveloppe protéique flexible connue sous le nom de couche protéique matricielle VP40. "Nous nous sommes toujours demandé comment ce long virus pouvait pénétrer dans la cellule, fusionner avec la membrane et libérer son génome", déclare le Dr Chlanda. Grâce à leur analyse structurelle de cellules infectées mais inactives, fournie par des collaborateurs de l'Institut Friedrich Loeffler de Greifswald, les chercheurs ont découvert que l'enveloppe protéique du virus se désassemble à un pH faible, c'est-à-dire dans un environnement acide. Cette étape n'est pas la moins décisive pour la formation des pores de fusion, comme l'ont montré d'autres simulations informatiques réalisées par les professeurs Schwarz et Nickel. Au cours de ce processus, les interactions électrostatiques de la matrice VP40 avec la membrane sont affaiblies, ce qui réduit la barrière énergétique de la formation des pores. Les résultats de la recherche fondamentale de Heidelberg suggèrent qu'un blocage du désassemblage de cette couche serait un moyen de maintenir les virus Ebola dans un état qui ne permet pas la formation de pores de fusion. Comme pour le virus de la grippe A, le virus Ebola serait alors attiré dans un piège dont il ne pourrait s'échapper.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
S. Winter, G. Golani, F. Lolicato, M. Vallbracht, K. Thiyagarajah, S. Sid Ahmed, C. Lüchtenborg, O. Fackler, B. Brügger, T. Hoenen, W. Nickel, Ulrich Schwarz, P. Chlanda: The Ebola virus VP40 matrix layer undergoes endosomal disassembly essential for membrane fusion. EMBO Journal e113578 (21 April 2023)