La modificación genética permite obtener células hepáticas más funcionales a partir de células madre
Las células hepáticas son indispensables para la investigación: para el ensayo de fármacos, para comprender mejor enfermedades como la hepatitis, el hígado graso, la cirrosis hepática o el cáncer de hígado y para el desarrollo de futuras terapias celulares. Sin embargo, la disponibilidad de células hepáticas humanas procedentes de biopsias y órganos de donantes es muy limitada. Por ello, la investigación requiere fuentes alternativas de células hepáticas.
La generación de hepatocitos (células hepáticas) a partir de células madre pluripotentes ofrece un enorme potencial para la investigación y futuras terapias. Sin embargo, aún no se han investigado suficientemente los procesos que hacen que las células madre funcionen como verdaderas células hepáticas. Un estudio reciente del Instituto Leibniz de Investigación Laboral de Dortmund (IfADo) demuestra ahora que la red de regulación génica del factor de transcripción del ADN CDX2 desempeña un papel decisivo en este problema.
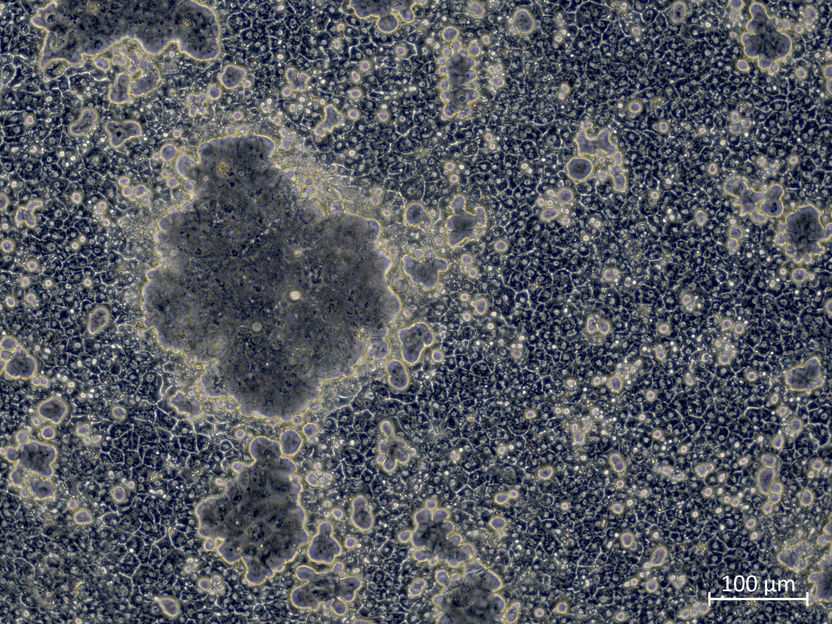
Cuando la red CDX2 está activa, las células madre del hígado forman canalículos biliares inusualmente grandes con enzimas intestinales.
Copyright: IfADo
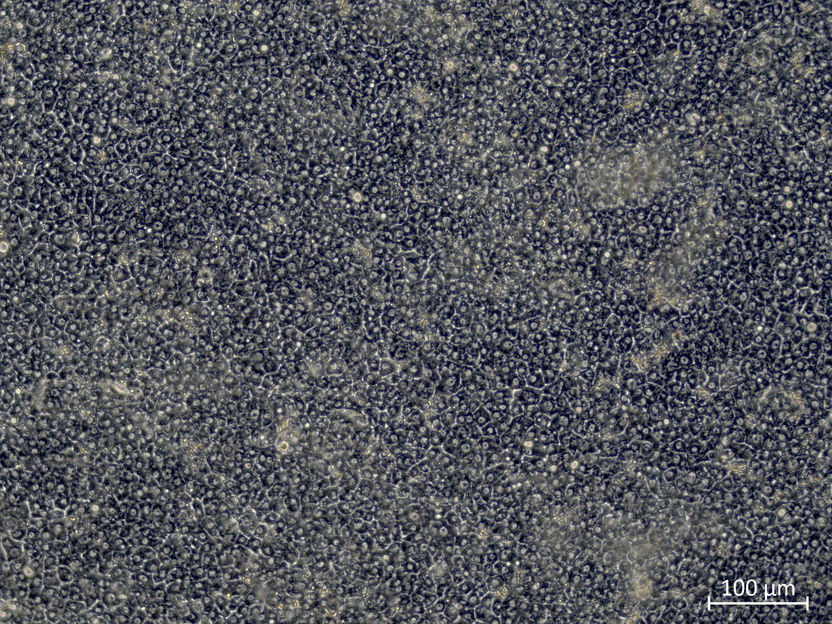
Si se desactiva CDX2, se forman los canalículos biliares típicos de las células hepáticas.
Copyright: IfADo

Intestino e hígado: las células muestran propiedades híbridas
En trabajos de investigación anteriores, el grupo de investigación "Redes reguladoras de la diferenciación de células madre (StemNet)", dirigido por el Dr. Patrick Nell, había demostrado que los métodos actuales de obtención de hepatocitos a partir de células madre conducen a las llamadas células híbridas, es decir, células que tienen propiedades tanto de células hepáticas como intestinales.
"Los hepatocitos y las células epiteliales del tracto intestinal tienen un origen común en el desarrollo embrionario, ya que el hígado se desarrolla a partir de una parte del tracto intestinal primitivo. Más adelante en el desarrollo, los distintos tipos celulares maduran, lo que está controlado por diferentes niveles de actividad en las redes de genes asociadas a los respectivos tipos celulares", explica Antonia Thomitzek, estudiante de doctorado en StemNet. "Nuestro limitado control sobre este proceso conduce a la formación de células híbridas que aún no reflejan fielmente la función de las células hepáticas fisiológicas".
El grupo de investigación de StemNet ha descubierto ahora que la red CDX2, inesperadamente activa durante la formación de células hepáticas a partir de células madre, desempeña un papel crucial en el desarrollo del fenotipo híbrido de los hepatocitos derivados de células madre. Al desactivar CDX2, pudieron evitar el desarrollo de características indeseables que son más típicas de las células intestinales que de los hepatocitos.
Unas tijeras genéticas permiten obtener hepatocitos más funcionales
En su estudio actual, los investigadores utilizaron el sistema de "tijeras genéticas" CRISPR-Cas9 para desactivar selectivamente el gen CDX2. CRISPR-Cas9 es un método de biología molecular para cortar y modificar el ADN en un lugar determinado. Si se desactiva CDX2 con este método, se impide casi por completo el desarrollo de las características intestinales típicas. En su lugar, las células desarrollan un fenotipo hepático distinto. Muestran funciones hepáticas mejoradas, como la formación correcta de conductos biliares y un transporte más eficiente de ácidos biliares. Estas propiedades son esenciales para unas células hepáticas funcionales.
"Comprender la influencia de las redes de genes en el desarrollo de la identidad celular es fundamental para el desarrollo de sistemas de modelos celulares y tisulares fiables basados en la tecnología de células madre", explica el Dr. Patrick Nell. "De este modo, impulsamos la investigación de alternativas adecuadas a los ensayos con animales y el desarrollo responsable de futuras terapias celulares".
Los resultados forman parte del proyecto "HyCell", financiado por la Fundación Alemana de Investigación con unos 408.000 euros y que se prolongará hasta 2028. Marcan un hito en el desarrollo ulterior de la tecnología de células madre, ya que unos sistemas in vitro más representativos para la investigación hepática podrían hacer más eficiente y seguro el desarrollo de fármacos y beneficiar las aplicaciones en medicina regenerativa.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Alemán se puede encontrar aquí.






















































