Cómo transportan su carga mortal las células inmunitarias
La precisión es crucial para las células inmunitarias: las células asesinas naturales y las células T eliminan las células infectadas o malignas liberando partículas altamente tóxicas de forma selectiva. Anna, MedUni Viena, MedUni Graz, el Hospital Universitario de Bonn (UKB) y la Universidad de Bonn ofrece ahora una visión más profunda de cómo se liberan los llamados gránulos citotóxicos.
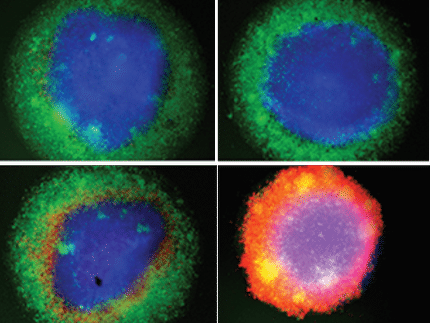
Imágenes de sinapsis inmunitarias formadas por células NK-92. Rojo: gránulos citotóxicos/líticos; verde: esfingolípidos, GM1 o GB3; cian: tinción de actina.
Copyright: Kalinichenko
En la revista Science Immunology, el equipo describe un vínculo inesperado entre el metabolismo de las grasas y la capacidad del sistema inmunitario para liberar su "carga letal" con precisión milimétrica, y aporta nuevos conocimientos sobre las enfermedades causadas por defectos genéticos.
Nuestro sistema inmunitario depende de células especializadas, como las células asesinas naturales (NK) y las células T, para detectar y destruir invasores peligrosos, como virus o células cancerosas. Para ello, liberan "paquetes" microscópicamente pequeños llenos de moléculas altamente tóxicas -conocidas como gránulos citotóxicos- que matan a las células infectadas o malignas. Aunque ya se han identificado algunas moléculas clave mediante el estudio de enfermedades inmunitarias, aún se desconocen otras moléculas que podrían ser importantes para este mecanismo de liberación.
En su último trabajo, publicado en Science Immunology, un equipo internacional de investigación dirigido por Kaan Boztug, catedrático de MedUni Vienna, jefe de grupo de investigación en St. Anna Children's Cancer Research, Investigador Principal Adjunto en el Centro de Investigación CeMM de Medicina Molecular y Director del Departamento de Inmunología Pediátrica y Reumatología de la UKB y miembro del Cluster de Excelencia ImmunoSensation2 de la Universidad de Bonn, junto con Artem Kalinichenko, Profesor Adjunto de la Universidad Médica de Graz y antiguo Postdoc Senior en el St. Anna Children's Cancer Research y en el Centro de Investigación CeMM de Medicina Molecular. Anna Children's Cancer Research y en el CeMM, y Jakob Huemer, antiguo estudiante de doctorado en el CeMM (ambos antiguos miembros del grupo de investigación de Kaan Boztug), hicieron un descubrimiento que amplía de forma fundamental nuestra comprensión de la defensa inmunitaria.
Utilizando métodos analíticos basados en las "tijeras genéticas" CRISPR, los investigadores descubrieron que un grupo inesperado de genes desempeña un papel central en la liberación de gránulos citotóxicos en las células NK y T humanas. Sorprendentemente, muchos de estos genes están relacionados con el metabolismo lipídico celular. El equipo pudo demostrar que ciertos lípidos ayudan a garantizar que proteínas importantes para la liberación controlada de los gránulos lleguen a su destino correcto dentro de las células inmunitarias - y así asegurar la eliminación precisa de células infectadas o malignas.
Este avance no sólo contribuye a comprender mejor el funcionamiento de las células inmunitarias, sino que también aporta nuevos conocimientos sobre las enfermedades causadas por defectos genéticos, como los trastornos neurológicos raros o las inmunodeficiencias congénitas.
"Investigando sistemáticamente las vías de señalización genética y combinando la genómica funcional con estudios de seguimiento mecanicista, hemos descubierto un nuevo grupo de genes que controlan el funcionamiento de las células T y NK y eliminan tanto las células infectadas por virus como las tumorales", afirma Artem Kalinichenko, coautor del estudio. "Estos hallazgos pueden ayudar a diagnosticar mejor las enfermedades genéticas y abrir el camino a nuevas terapias a largo plazo".
"Es fascinante ver que moléculas conocidas originalmente en neurobiología y asociadas al metabolismo y modificación de lípidos son también cruciales para un mecanismo específico de defensa inmunitaria", añade Jakob Huemer, también coprimer autor del estudio. "Nuestros resultados plantean nuevas preguntas sobre cómo las vías de señalización celular comunes influyen en sistemas biológicos muy diferentes".
"Este trabajo muestra el potencial de la investigación colaborativa impulsada por la curiosidad", resume el autor principal, Kaan Boztug. "Hemos podido descubrir una conexión totalmente inesperada entre la biología de los lípidos y la función de las células inmunitarias, vinculando procesos biológicos aparentemente independientes. Estos hallazgos nos ayudarán a mejorar el diagnóstico de pacientes con inmunodeficiencias raras y también son relevantes para el futuro desarrollo de enfoques para la inmunoterapia del cáncer."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Alemán se puede encontrar aquí.
Publicación original
Artem Kalinichenko, Jakob Huemer, Theresa Humer, Matthias Haimel, Michael Svaton, Nicolas Socquet-Juglard, Giovanna Perinetti Casoni, Celine Prakash, Maximilian von der Linde, Julia Pazmandi, et al.; "Protein palmitoylation and sphingolipid metabolism control regulated exocytosis in cytotoxic lymphocytes"; Science Immunology, Volume 10