La modification génétique permet d'obtenir des cellules hépatiques plus fonctionnelles à partir de cellules souches
Les cellules hépatiques sont indispensables à la recherche - pour les tests de médicaments, pour une meilleure compréhension de maladies telles que l'hépatite, le foie gras, la cirrhose ou le cancer du foie et pour le développement de futures thérapies cellulaires. La disponibilité des cellules hépatiques humaines issues de biopsies et de dons d'organes est toutefois très limitée. La recherche a donc besoin de sources alternatives de cellules hépatiques.
La production d'hépatocytes (cellules hépatiques) à partir de cellules souches pluripotentes offre un énorme potentiel pour la recherche et les thérapies futures. Mais jusqu'à présent, les processus qui permettent aux cellules souches de fonctionner comme de véritables cellules hépatiques n'ont pas été suffisamment étudiés. Une étude récente de l'Institut Leibniz pour la recherche sur le travail à Dortmund (IfADo) le montre maintenant : le réseau de régulation génétique du facteur de transcription ADN CDX2 joue un rôle décisif dans ce problème.
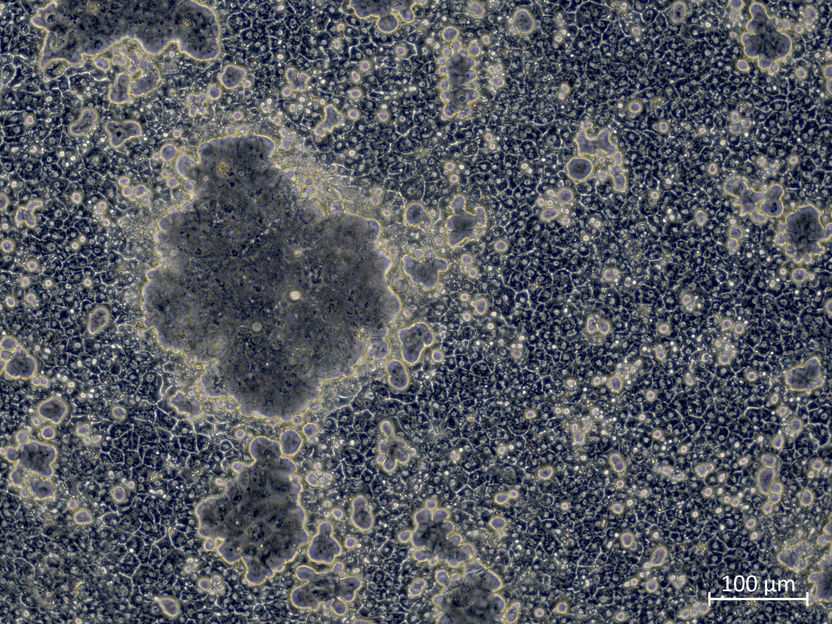
Lorsque le réseau CDX2 est actif, les cellules souches hépatiques forment des canalicules biliaires inhabituellement grands avec des enzymes intestinales.
Copyright: IfADo
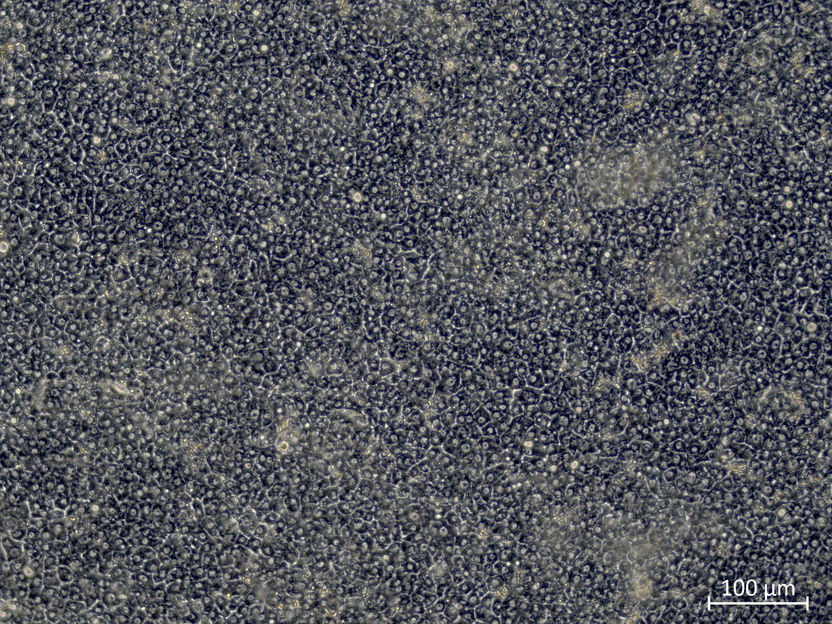
Si CDX2 est désactivé, les canalicules biliaires typiques des cellules hépatiques se forment.
Copyright: IfADo

Intestin et foie : les cellules présentent des propriétés hybrides
Dans des travaux de recherche antérieurs, le groupe de recherche "Réseaux régulateurs de la différenciation des cellules souches (StemNet)", dirigé par le Dr Patrick Nell, avait montré que les méthodes actuelles d'obtention d'hépatocytes à partir de cellules souches aboutissent à des cellules dites hybrides - des cellules qui possèdent à la fois des propriétés de cellules hépatiques et de cellules intestinales.
"Les hépatocytes et les cellules épithéliales du tractus intestinal ont une origine commune au cours du développement embryonnaire, puisque le foie se développe à partir d'une partie du tractus intestinal primitif. Au cours du développement ultérieur, les différents types de cellules arrivent à maturité, ce qui est contrôlé par différents niveaux d'activité dans les réseaux de gènes associés à chaque type de cellule", explique Antonia Thomitzek, doctorante chez StemNet. "Notre contrôle limité sur ce processus conduit à la formation de cellules hybrides qui ne reflètent pas encore fidèlement la fonction des cellules hépatiques physiologiques".
Le groupe de recherche StemNet a maintenant découvert que le réseau CDX2, qui est inopinément actif pendant la formation des hépatocytes à partir de cellules souches, joue un rôle crucial dans la formation du phénotype hybride des hépatocytes dérivés de cellules souches. En désactivant CDX2, ils ont pu empêcher l'apparition de propriétés indésirables qui sont plus typiques des cellules intestinales que des hépatocytes.
Des ciseaux génétiques permettent d'obtenir des cellules hépatiques plus fonctionnelles
Dans leur étude actuelle, les chercheurs ont utilisé le système de "ciseaux génétiques" CRISPR-Cas9 pour désactiver sélectivement le gène CDX2. CRISPR-Cas9 est une méthode de biologie moléculaire permettant de couper et de modifier l'ADN à un endroit choisi. Lorsque CDX2 est désactivé par cette méthode, le développement de caractéristiques typiques de l'intestin est presque totalement empêché. Au lieu de cela, les cellules développent un phénotype hépatique clair. Elles présentent des fonctions hépatiques améliorées, comme la formation correcte de canaux biliaires et un transport plus efficace des acides biliaires. Ces caractéristiques sont essentielles pour des cellules hépatiques fonctionnelles.
"La compréhension de l'influence des réseaux de gènes sur la formation de l'identité cellulaire est fondamentale pour le développement de systèmes fiables de modélisation des cellules et des tissus basés sur la technologie des cellules souches", explique le Dr Patrick Nell. "De cette manière, nous faisons progresser la recherche sur les alternatives appropriées à l'expérimentation animale et le développement responsable des futures thérapies cellulaires".
Les résultats font partie du projet "HyCell", qui est financé par la Deutsche Forschungsgemeinschaft à hauteur d'environ 408 000 euros et qui durera jusqu'en 2028. Ils marquent une étape importante dans le développement de la technologie des cellules souches, car des systèmes in vitro plus représentatifs pour la recherche sur le foie pourraient rendre le développement de médicaments plus efficace et plus sûr et bénéficier à des applications dans la médecine régénérative.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Allemand peut être trouvé ici.