El "selenosoma": La coreografía que rige la recodificación
La criomicroscopía electrónica visualiza las estructuras celulares
Un equipo dirigido por investigadores de la Charité - Universitätsmedizin Berlin ha logrado descifrar un proceso fundamental de la biología molecular: la incorporación de selenocisteína -el "aminoácido número 21"- a las proteínas que contienen selenio, conocidas como selenoproteínas. Estas construcciones proteicas son esenciales para la supervivencia de los seres humanos y otros mamíferos, así como de algunos microorganismos. Sin embargo, hasta ahora se desconocía el modo preciso en que estas proteínas se sintetizan y ensamblan en nuestro organismo. En Science, los autores proporcionan la primera descripción detallada de cómo un bolsillo de unión específico interactúa con otros factores para facilitar este proceso.
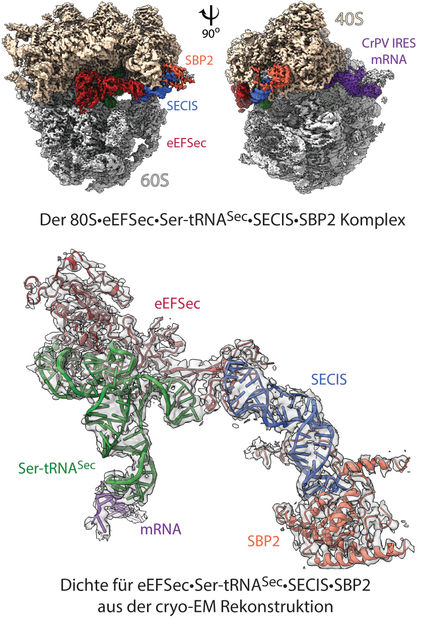
Estructura del "selenosoma": reconstrucción por microscopía electrónica crio 3D del complejo ribosómico con una resolución de 2,8 Å (arriba). La imagen muestra las subunidades 40S y 60S del ribosoma, con un etiquetado que indica los elementos de unión (ligandos): ARNm y otros factores que contribuyen. En el modelo (abajo), la densidad resaltada para los factores eEFSec-Ser-tRNASec-SECIS-SBP2 muestra cómo se disponen los elementos individuales dentro del ribosoma 80S, y cómo se logra la recodificación.
© Charité | C. M. T. Spahn
Las selenoproteínas son un grupo inusual de proteínas que se han descubierto hace relativamente poco tiempo. Los científicos estiman que existen hasta 50 de estas proteínas, pero sólo se han estudiado algunas de ellas. Todas las selenoproteínas tienen estructuras complejas que se centran en al menos una parte del aminoácido que les da nombre: la selenocisteína (Sec). Las selenoproteínas desempeñan un importante papel protector y defensivo en el cuerpo humano, tanto a nivel celular como del organismo. Funcionan principalmente como oxidorreductasas, es decir, mediadoras de reacciones químicas clave, y como mediadoras de la función tiroidea. También se cree que las selenoproteínas ayudan a proteger el organismo contra el cáncer, ya que contienen el elemento selenio, capaz de reducir rápidamente el estrés oxidativo.
¿Cómo se forman estas proteínas especiales? ¿Cuál es la coreografía molecular que establece los pasos de la incorporación de selenocisteína durante la biosíntesis de las proteínas? ¿Cuál es la estructura precisa del selenosoma, el complejo que se forma para facilitar la síntesis de selenoproteínas? El equipo dirigido por el Prof. Dr. Christian Spahn, Director del Instituto de Física Médica y Biofísica de la Charité, y el Dr. Tarek Hilal, del Instituto de Química y Bioquímica de la Universidad Libre de Berlín, ha trabajado con socios del Instituto Max Planck de Genética Molecular, la Universidad de Illinois Chicago y la Escuela de Medicina Robert Wood Johnson de Nueva Jersey, para visualizar y comprender las estructuras y los pasos que intervienen en este proceso fundamental de la biología molecular.
Los ribosomas, conocidos como las fábricas de proteínas de la célula, suelen sintetizar las proteínas siguiendo estrictos planos entregados por las moléculas de ARN mensajero (ARNm). El código genético universal utiliza secuencias específicas formadas por combinaciones de tripletes (codones) de cuatro bases diferentes. Cada codón forma una unidad de información genética que codifica un aminoácido concreto. Sin embargo, la estructura específica de las selenoproteínas requiere algo más que el conjunto básico de 20 aminoácidos. Todas las selenoproteínas contienen selenocisteína (Sec), que se conoce como el 21º aminoácido.
La selenocisteína no tiene su propio codón designado, lo que significa que, a diferencia de los otros aminoácidos, no está codificada por un triplete de bases específico. Por lo tanto, los ribosomas deben adquirir un conjunto muy especial de características durante la síntesis de selenoproteínas. El ribosoma es reprogramado por una secuencia especial de señalización del ARNm conocida como elemento SECIS (secuencia de inserción de selenocisteína), que efectivamente sobrescribe el código genético existente. Un codón específico -que normalmente señala la terminación del proceso de traducción y, por tanto, la liberación de la cadena proteica emergente (codón de parada UGA)- se recodifica así para insertar selenocisteína en las proteínas. Además del elemento SECIS, este proceso de recodificación también requiere una especie específica de ARN de transferencia (tRNASec) que transporta selenocisteína y otros factores especiales de traducción. "Aunque los actores implicados se conocen desde hace varios años, sus funciones e interacciones precisas habían permanecido en el misterio hasta ahora", afirma el profesor Spahn, y añade: "Un misterio particular era la acción precisa del elemento SECIS, que no está situado muy cerca del codón de parada UGA recodificado, sino al final de la secuencia lineal del ARNm, a muchos cientos de bloques de construcción de nucleótidos".
Para dilucidar el mecanismo molecular implicado, los investigadores empezaron por recrear en el laboratorio el "selenosoma", el complejo ribosómico que se forma para recodificar el codón de parada UGA. Utilizando una tecnología de imagen de alta resolución conocida como criomicroscopía electrónica, los investigadores produjeron entonces una visualización en 3D del diminuto complejo, lo que les permitió estudiar su estructura. "Utilizando nuestras visualizaciones estructurales, pudimos entonces determinar cómo los factores implicados interactúan con el ribosoma y cómo estas interacciones reprograman el ribosoma", explica el profesor Spahn. "En concreto, pudimos demostrar que el ARNm forma un gran bucle, lo que significa que el codón de parada UGA y el elemento SECIS se unen al ribosoma al mismo tiempo. El elemento SECIS se ancla a través de un bolsillo de unión previamente desconocido en el ribosoma y, mientras está unido al ribosoma, puede promover la inserción de selenocisteína con la ayuda de los factores de traducción." Tanto la estructura del selenosoma como su mecanismo fueron una sorpresa para los investigadores. Ninguno de los dos podría haberse predicho, ya que el proceso de inserción de la selenocisteína en los seres humanos y otros mamíferos es claramente diferente del que se conoce en las bacterias. El complejo descrito en este estudio es un ejemplo del modo en que las estructuras de señalización situadas en el extremo posterior de la cadena de ARNm (es decir, fuera de la región codificante) pueden interactuar con el ribosoma para controlar su función.
Los investigadores lograron dilucidar el primer paso del proceso de inserción de selenocisteína. Los pasos posteriores siguen sin estar claros y se abordarán en futuros estudios. Investigaciones como ésta contribuyen a aumentar nuestra comprensión de la función vital del oligoelemento selenio en el organismo, así como la importancia de su papel en la fisiología normal y en el desarrollo de enfermedades como la diabetes y el cáncer.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.