Agentes entre el bien y el mal
Se cuestiona la teoría del estrecho rango de hospedaje de los fagos: ¿consecuencias para la terapia fágica?
Los virus que infectan a las bacterias podrían sustituir algún día a los antibióticos porque atacan con precisión sólo a determinados patógenos. Investigadores de la ETH de Zúrich demuestran ahora que no siempre es así. Este nuevo hallazgo es importante porque los virus bacterianos pueden transferir genes de resistencia a los antibióticos.
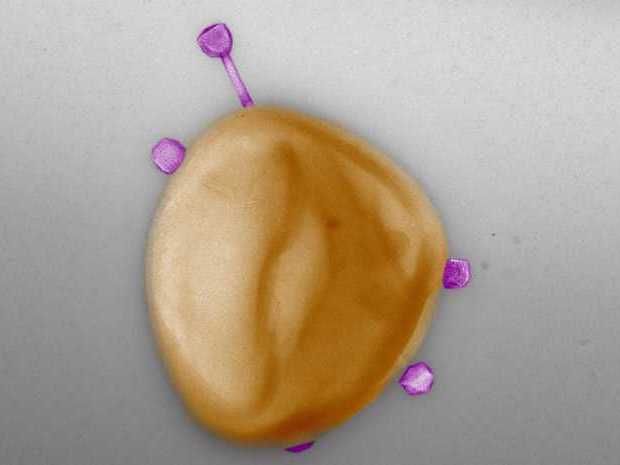
Varios fagos infectan simultáneamente una célula estafilocócica en un experimento. Es muy posible que uno de ellos lleve en su genoma un gen de resistencia a los antibióticos.
Pauline Göller/ETH Zürich
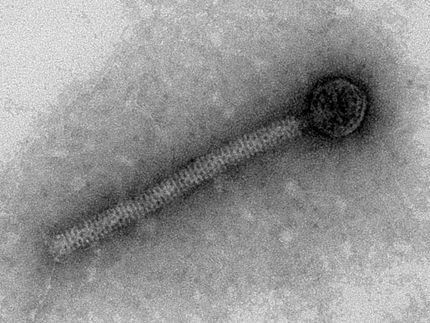
Los bacteriófagos, o fagos, son virus que sólo infectan a las bacterias. Para capturar un huésped bacteriano, primero se adhieren a moléculas específicas de su superficie celular. A continuación, inyectan su material genético en la célula bacteriana. Para reprogramar la maquinaria celular de la bacteria y producir nuevas partículas de virus, los fagos también tienen que burlar el sistema inmunitario de la bacteria objetivo.
Los puntos de entrada moleculares y el sistema inmunitario difieren de una bacteria a otra, por lo que se creía comúnmente que la mayoría de los fagos tienen un rango de hospedaje estrecho, es decir, que sólo infectan una única especie o incluso subespecie bacteriana. Esto es también lo que impulsó la idea de utilizar matabacterias naturales para tratar infecciones, sobre todo cuando las bacterias causantes de la enfermedad han adquirido resistencia a los antibióticos.
Ahora, sin embargo, un estudio dirigido por Elena Gómez-Sanz, investigadora asociada del grupo de Martin Loessner, catedrático de Microbiología Alimentaria de la ETH de Zúrich, pone en entredicho la teoría del estrecho rango de hospedadores de los fagos. Los fagos del grupo de bacterias Staphylococcus suelen infectar a varias especies simultáneamente. Los investigadores han publicado recientemente sus resultados en la revista Nature Communications.
Sus hallazgos podrían tener consecuencias directas para la terapia con fagos, cuyo uso aún no está aprobado en Suiza, pero que se utiliza desde hace tiempo en Europa del Este. Los fagos no sólo matan bacterias, sino que también pueden transferir genes de resistencia a los antibióticos de una bacteria a otra. En consecuencia, su inesperada amplitud de presas significa que los fagos podrían propagar sus genes de resistencia mucho más lejos en el medio ambiente de lo que se pensaba.
Muchos fagos nuevos aislados en aguas residuales
Ya se conoce el mecanismo por el que los fagos pueden transferir la resistencia a los antibióticos entre las bacterias. En resumen, cuando estos virus se multiplican en las células bacterianas, no sólo inyectan su propio material genético en nuevas partículas de virus; en algunos casos, introducen de contrabando material genético de la bacteria infectada -un gen de resistencia, por ejemplo- en las partículas de virus. Si una de estas partículas víricas infecta entonces a una nueva bacteria, la resistencia puede ser transferida.
En los estafilococos, esta forma de transferencia de genes se ha estudiado especialmente bien. Este grupo de bacterias, que comprende más de 50 especies, coloniza de forma natural no sólo a los seres humanos, sino también al ganado, y se encuentra en las masas de agua naturales. El miembro más conocido de este grupo es el Staphylococcus aureus, una especie bacteriana que coloniza naturalmente nuestra nariz y nuestra piel, pero que recientemente se ha convertido en un peligroso patógeno multirresistente.
Se cree que los fagos han desempeñado un papel crucial en la evolución del patógeno multirresistente más común y extendido de la actualidad. Por ello, no es de extrañar que más del 90 por ciento de los fagos conocidos en los estafilococos procedan del Staphylococcus aureus, generalmente aislado de muestras clínicas.
"Sin embargo, si queremos evaluar el papel de los fagos como vectores de la resistencia a los antibióticos, tenemos que ver el panorama completo, no sólo la situación en la medicina humana", dice Gómez-Sanz.
Los investigadores de la ETH visitaron plantas de tratamiento de aguas residuales en busca de una gama lo más amplia posible de fagos naturales de Staphylococcus. Al fin y al cabo, aquí confluyen una gran diversidad de bacterias y sus fagos, procedentes de la microbiota humana, de la ganadería y de los hogares y la industria. Los investigadores aislaron un total de 94 fagos de las aguas residuales para su estudio.
Los virus abarcan una gigantesca red de transferencia de genes
Los investigadores realizaron experimentos de laboratorio para identificar el patrón de presa natural de sus fagos aislados. Para ello, soltaron a los fagos en diferentes bacterias huéspedes potenciales y estudiaron sus patrones de infección. Las 117 cepas bacterianas que estudiaron en total incluían representantes de 29 especies diferentes de Staphylococcus y bacterias de distintos hábitats, con y sin resistencia a los antibióticos.
Descubrieron que un fago infecta, por término medio, a cuatro especies bacterianas diferentes. O, desde el punto de vista de las bacterias, los fagos "compartidos" pueden permitir que una especie de estafilococo intercambie material genético con, por término medio, más de otras 17 especies. "Esta enorme red muestra el tremendo impacto que los fagos pueden tener en las comunidades bacterianas", afirma Gómez-Sanz.
La hipótesis del estrecho rango de hospedadores probablemente haya sobrevivido tanto tiempo porque apenas hay estudios similares anteriores que investiguen la infectividad de los fagos en muchas especies bacterianas diferentes, dice el microbiólogo. Los trabajos anteriores solían limitarse estrictamente a especies bacterianas de importancia clínica, como S. aureus. Sin embargo, el presente estudio pone de manifiesto la urgente necesidad de investigar especialmente la prevalencia de la resistencia a los antibióticos más allá del ámbito de las biosferas individuales.
"La salud humana está estrechamente relacionada con la salud de los animales y el medio ambiente", afirma Gómez-Sanz. El estudio subraya la importancia del moderno "enfoque de una sola salud" en el uso de los antibióticos. Los nuevos hallazgos sobre la red de fagos naturales individuales muestran, por ejemplo, que los fagos podrían transferir las resistencias a los antibióticos de las bacterias de la microbiota animal directamente a los patógenos humanos. Esto subraya la importancia del moderno "enfoque de salud único" en el uso de los antibióticos.
Aún no está claro con qué frecuencia se propagan los genes de resistencia
Es difícil estimar, a partir de los experimentos de laboratorio realizados hasta la fecha, con qué frecuencia los fagos transfieren realmente los genes de resistencia a los antibióticos en la naturaleza. No obstante, el estudio actual hace una suposición sobre cuáles de los fagos investigados son vectores especialmente potentes.
Para 28 de los 94 fagos, los investigadores de la ETH investigaron con qué frecuencia pueden captar un gen de resistencia natural mientras se propagan los fagos en una bacteria de la red generada. La frecuencia de captación varió entre 1 de cada 100 partículas y 1 de cada 10 millones.
Estas enormes diferencias se deben a los distintos ciclos de vida y a las enzimas que utilizan los virus para empaquetar su material genético. "Algunos son 'más propensos a errores' que otros, lo que significa que tienden a incluir algo de material genético bacteriano en el paquete", explica Gómez-Sanz. Si, además, este tipo de fagos tienen un amplio rango de huéspedes, el riesgo de una transferencia es aún mayor.
Como subrayan los autores, los resultados del estudio también son significativos en lo que respecta a la lucha contra las bacterias patógenas en el ser humano mediante el uso de fagos. El descubrimiento de que los fagos pueden tener una amplia gama de huéspedes debe considerarse positivo. Esto facilita su uso contra numerosas bacterias diferentes.
Sin embargo, al utilizar los fagos en medicina, hay que tener cuidado de que no actúen además como vectores de genes de resistencia a los antibióticos. Por tanto, es importante asegurarse de que los fagos utilizados en medicina tengan un mecanismo de propagación que funcione lo mejor posible.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.