Cómo se pueden reactivar las células inmunitarias "paralizadas" contra los tumores cerebrales
Las células tumorales cerebrales con una determinada mutación común reprograman las células inmunitarias invasoras. Esto conduce a la parálisis de la defensa inmunitaria del organismo contra el tumor en el cerebro. Investigadores de Heidelberg, Mannheim y Friburgo descubrieron este mecanismo y al mismo tiempo identificaron una forma de reactivar el sistema inmunitario paralizado para que luche contra el tumor. Estos resultados confirman que las vacunas terapéuticas o las inmunoterapias son más eficaces contra los tumores cerebrales si se utilizan simultáneamente sustancias activas para promover el sistema inmunitario suprimido.
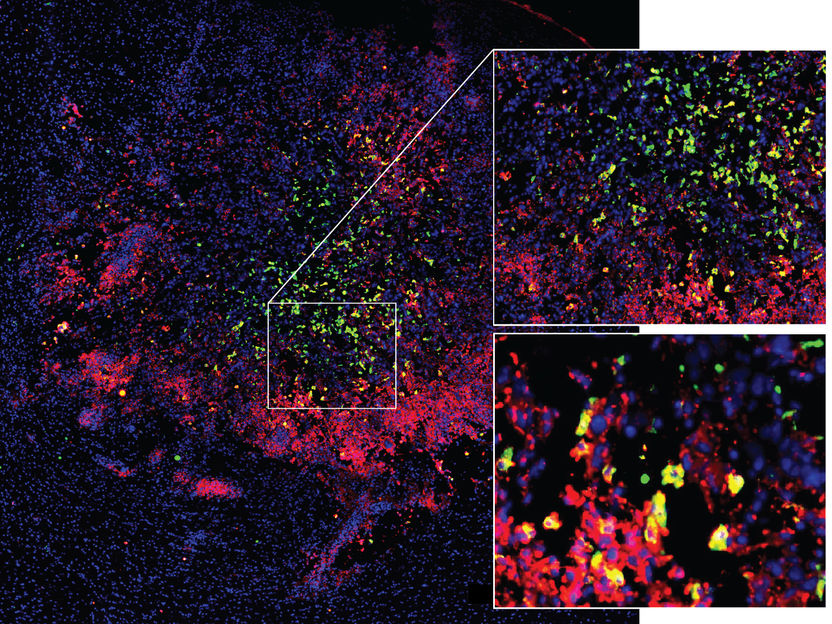
La microglía y los macrófagos migran a un tumor cerebral y se reprograman durante este proceso. Rojo: Estado activado; gre inmunosupresor, estado "paralizado", amarillo: transición entre el estado activado y el inmunosupresor.
Mirco Friedrich / DKFZ
Los gliomas difusos suelen ser tumores cerebrales incurables que se extienden por el cerebro y son difíciles de extirpar completamente mediante cirugía. La quimioterapia y la radioterapia también suelen tener un efecto limitado. Por ello, los oncólogos tratan de encontrar urgentemente enfoques de tratamiento innovadores para combatir los gliomas utilizando el sistema inmunitario, mediante vacunas terapéuticas o inmunoterapias.
Los gliomas no están formados exclusivamente por células cancerosas: hasta el 50% de la masa tumoral está formada por células de la microglía -los fagocitos propios del cerebro- y por macrófagos que entran en el tumor a través de los vasos sanguíneos. Los macrófagos también son células carroñeras, pero no son eficaces para combatir las células tumorales.
"Si queremos avanzar en el desarrollo de inmunoterapias o vacunas terapéuticas, tenemos que entender exactamente cómo se comporta el entorno inmunitario durante el desarrollo del tumor. Además, nos interesaba saber si las características genéticas especiales de los gliomas tienen una influencia particular en la función de las células inmunitarias asociadas al glioma", explicó Michael Platten, director del Departamento de Neurología de la Medicina Universitaria de Mannheim, jefe de división del Centro Alemán de Investigación del Cáncer (DKFZ), y director del estudio actual.
Los científicos de la división de Platten se han unido ahora a Marco Prinz, director médico del Instituto de Neuropatología de Friburgo, y a su grupo de trabajo para publicar un "análisis del estado" molecular de las células inmunitarias asociadas al glioma. Para ello, estudiaron específicamente los perfiles de ARN y proteínas de las células individuales de la microglía y los macrófagos. Utilizando modelos tumorales en ratones, también pudieron demostrar la evolución del entorno inmunitario a lo largo de la enfermedad.
El producto metabólico de las células del glioma paraliza las células inmunitarias del cerebro
Los investigadores estaban especialmente interesados en los tumores con lo que se conoce como mutación IDH, que se encuentra en alrededor del 70% de todos los gliomas de bajo grado. Estas células tumorales presentan una mutación idéntica que hace que se intercambie un bloque de construcción proteico concreto en la enzima IDH.
Como resultado de la mutación de la IDH, las células del glioma liberan el producto metabólico (R)-2-HG que promueve el cáncer y que, como descubrieron los investigadores, afecta a los macrófagos invasores. Estas células carroñeras se reprograman, por así decirlo, bloqueando la respuesta inmunitaria contra el tumor: liberan sustancias mensajeras que suprimen el sistema inmunitario e inhiben la actividad de las células T; los investigadores lo denominan "parálisis inmunitaria". "En última instancia, la mutación IDH permite a los gliomas protegerse contra el sistema inmunitario humano", explicó Mirco Friedrich, investigador del DKFZ y médico del Hospital Universitario de Heidelberg, uno de los autores principales de la presente publicación.
Posteriormente, los investigadores pudieron descifrar el mecanismo molecular por el que (R)-2-HG reprograma los macrófagos: el producto metabólico promotor del cáncer interfiere en el metabolismo de los aminoácidos de las células carroñeras. Esto conduce a la activación de una molécula reguladora del sistema inmunitario central, el receptor de hidrocarburos de arilo. El receptor activado provoca la inmunosupresión de los macrófagos.
Reactivación del sistema inmunitario paralizado
En vista de este papel central del receptor de hidrocarburos de arilo, los investigadores decidieron desactivar específicamente la función de esta molécula clave. Para ello, utilizaron una sustancia específica desarrollada conjuntamente por el DKFZ y Bayer. Combinaron esta sustancia con una inmunoterapia especial, conocida como inhibidor del punto de control inmunitario. Esta inmunoterapia es normalmente ineficaz, pero la combinación la hizo efectiva en un modelo animal y prolongó la vida de los ratones con tumores mutantes de IDH.
"De este modo, hemos demostrado por primera vez que las células carroñeras asociadas al glioma "paralizadas" pueden reactivarse específicamente mediante fármacos en gliomas con mutación IDH", señaló Mirco Friedrich. "El trabajo es un buen ejemplo de cómo los estudios de una sola célula pueden conducir a un mecanismo de tratamiento", añadió Roman Sankowski, del Hospital Universitario de Friburgo. Como explicó Lukas Bunse, médico del DKFZ y de la Universidad de Medicina de Mannheim, "hace poco pudimos demostrar en un primer estudio clínico que una vacuna terapéutica contra los gliomas difusos con mutación IDH desencadena la respuesta inmunitaria deseada en los sujetos del estudio. Nuestros estudios actuales demuestran ahora cómo sortear el entorno inmunosupresor del cerebro y mejorar aún más la eficacia de esta vacuna. Se trata de un resultado alentador que demuestra que el sistema inmunitario puede ayudar a combatir más eficazmente esta enfermedad actualmente casi incurable." Ahora se llevarán a cabo estudios clínicos para revelar si esta estrategia de tratamiento es una opción prometedora para los pacientes de glioma.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.