Apuntando a la enzima SARS-CoV-2 con inhibidores
El virus COVID-19 tiene un talón de Aquiles, lo que lo convierte en un excelente blanco para los inhibidores o los nuevos medicamentos
A medida que la pandemia de Covid-19 causada por el coronavirus SARS-CoV-2 continúa extendiéndose por todo el mundo, muchos investigadores están estudiando modelos epidemiológicos para predecir su propagación.
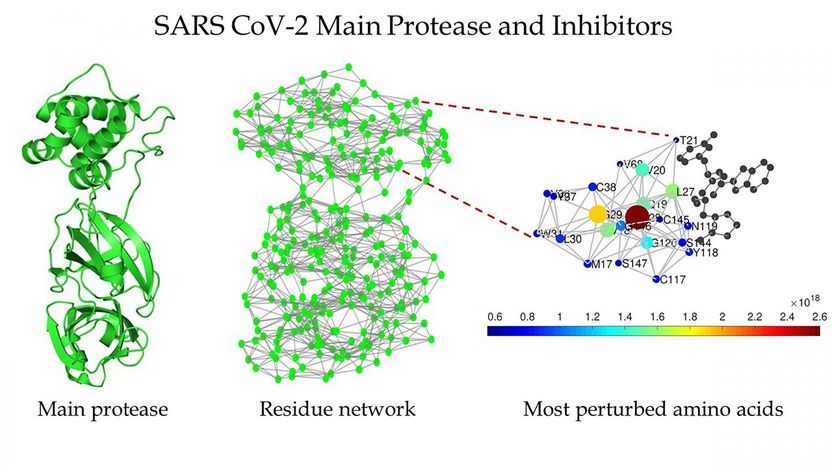
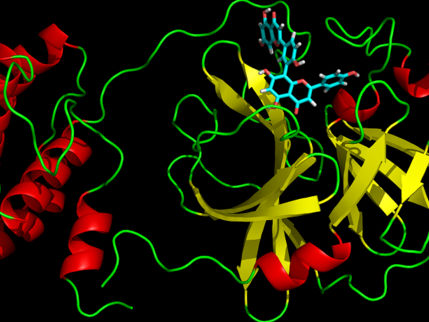
Esquema de la proteasa principal del SARS CoV-2 (izquierda), la red de residuos proteicos de la proteasa principal del SARS CoV-2 (centro), y una vista ampliada de la región alrededor del sitio de unión detectado por Estrada (derecha).
Ernesto Estrada
Sin embargo, Ernesto Estrada, matemático y experto en sistemas complejos de la Fundación ARAID de la Universidad de Zaragoza, decidió centrarse en la búsqueda de objetivos dentro del SARS-CoV-2 para que los nuevos fármacos ataquen. Por sus trabajos anteriores, sabía que la principal proteasa del virus, una enzima encargada del procesamiento proteolítico de las poliproteínas, es un excelente objetivo.
En la revista Chaos, de la editorial AIP, Estrada dijo que cuando él y sus colegas descubrieron un aumento dramático en la sensibilidad de la principal proteasa del SARS-CoV-2 a pequeñas perturbaciones, les hizo sospechar que hay un papel que los inhibidores pueden desempeñar para matar el virus.
Los inhibidores son moléculas orgánicas, drogas o nuevos compuestos químicos que se unen al sitio de unión de la proteasa para inhibir su trabajo. Un virus morirá sin que una enzima proteolítica trabaje para él.
"Me di cuenta de que los químicos ya habían encontrado algunos potentes inhibidores de la principal proteasa del SARS-CoV-2, y que habían resuelto la estructura de esta proteína a través de la cristalografía de rayos X", dijo. "Fue impactante ver que esta proteasa es muy similar a la del coronavirus del SARS, que produjo las epidemias de 2003, el SARS-CoV-1".
Cuando los investigadores superpusieron ambas estructuras una encima de la otra, coincidieron casi perfectamente.
"Si se alinean las secuencias de aminoácidos de ambas proteasas, sólo hay 12 de los 306 residuos que no coinciden", dijo Estrada. "¿Hay algo oculto detrás de estas aparentes similitudes entre las dos proteasas? ¿Podemos aprender algo de ellas para mejorar el diseño de las drogas contra el virus?"
El grupo de Estrada tiene una amplia experiencia en el análisis de redes - como las redes sociales, Internet, o las cadenas alimenticias entre especies dentro de un ambiente - y decidió tratar una proteína como red.
"Se denominan redes de residuos proteicos, donde representamos cada aminoácido como un nodo, y la interacción entre dos aminoácidos está representada por un vínculo entre ambos", explicó.
Encontraron varias estructuras de la proteasa principal del SARS CoV-1 y del SARS CoV-2 que estaban limpias, lo que significa que no contienen mutaciones, ligandos o solventes dentro de sus estructuras. Transformaron su estructura en redes de residuos de proteínas.
Estrada dijo que la mayoría de las medidas tradicionales de la red revelaron que ambas estructuras eran muy similares entre sí, algo que su equipo ya sabía. "Pero hace un par de años, desarrollamos una medida matemática más sofisticada que nos permite detectar cuán lejos puede propagarse una perturbación dentro de una red. Ese trabajo era de naturaleza muy teórica y matemática, pero habíamos especulado que podría ser útil para el estudio de las proteínas".
Así que lo pusieron a prueba. Reveló que la proteasa del SARS-CoV-2 es 1.900% más sensible a la transmisión de perturbaciones a largo plazo que la proteasa del SARS-CoV-1.
"Esto significa que cuando una proteína es perturbada, por ejemplo por el agua dentro del ambiente intracelular, tales perturbaciones son transmitidas a través de una red de intraresiduos que forman la estructura tridimensional de la proteína", dijo Estrada. "Si tal perturbación se produce alrededor de un aminoácido dado dentro de la proteasa del SARS-CoV-1, se transmite sólo a través de un entorno cercano alrededor de ese aminoácido perturbado".
Pero si esta perturbación se produce en un aminoácido dentro de la proteasa del SARS-CoV-2, se transmite a casi toda la red, incluso a aminoácidos muy lejanos.
"Es notable, porque significa que con pequeñas diferencias estructurales la proteasa del SARS-CoV-2 es mucho más efectiva dentro de las comunicaciones intraresiduales", dijo Estrada. "Debería ser mucho más efectiva en su trabajo como enzima proteolítica del virus". El diablo hizo un trabajo casi perfecto aquí, pero dejó la puerta abierta. Esta gran sensibilidad de la proteasa SARS-CoV-2 a las perturbaciones puede ser su talón de Aquiles en relación con los inhibidores".
El enfoque del grupo puede utilizarse en protocolos de detección masiva para identificar los potentes inhibidores de la proteasa principal del SARS-CoV-2 y, por consiguiente, para el desarrollo de nuevos medicamentos para eliminarla.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.