Observación en tiempo real de los procesos enzimáticos en el ADN
La comprensión de los procesos moleculares involucrados en la detección de roturas de cadenas de ADN
La ruptura de las cadenas de ADN puede contribuir al desarrollo del cáncer y al proceso de envejecimiento. Investigadores de los Departamentos de Biología y Química de la Universidad de Constanza han podido observar en tiempo real los procesos moleculares que tienen lugar en las roturas de cadenas de ADN por medio de la espectroscopia infrarroja.
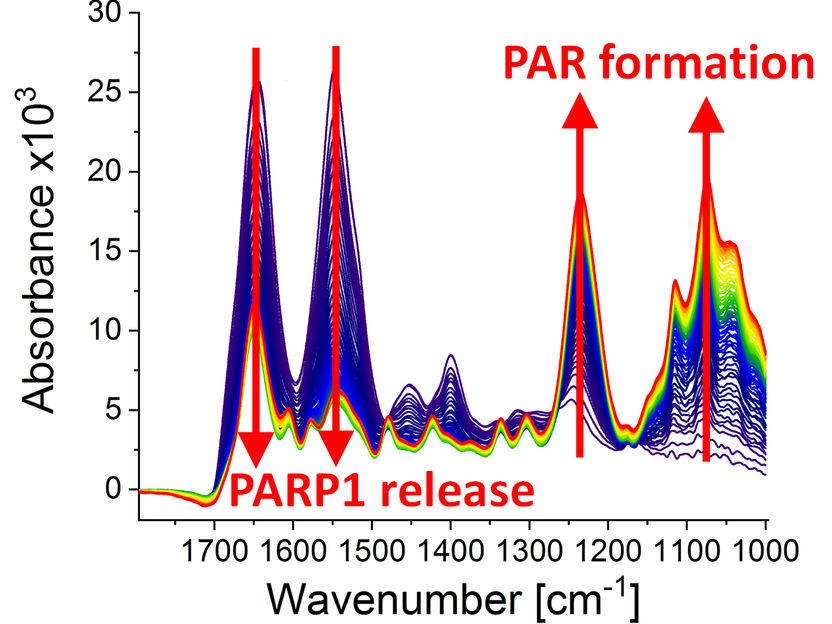
Espectros infrarrojos en diferentes puntos de tiempo (0-79 min) después de que la reacción de poli(ADP-ribosil)ación comenzara debido a la adición del substrato PARP1 NAD+. Se puede observar lo siguiente: la formación dinámica del biopolímero poli(ADP-ribosa) (bandas de absorción a 1236 cm-1 y 1074 cm-1) y el desprendimiento de PARP1 de la ruptura de la cadena de ADN (bandas de absorción a 1645 cm-1 y 1548 cm-1).
Modified from Krüger et al., “Real-time monitoring of PARP1-dependent PARylation by ATR-FTIR-spectroscopy”, Nature Communications, 1 May 2020. DOI: 10.1038/s41467-020-15858-w.
Los daños en el ADN en general y las roturas de cadenas de ADN en particular ocurren todos los días en todas las células del cuerpo humano. Ello se debe a influencias internas, como los radicales libres, que se producen durante los procesos inflamatorios y la respiración celular, y externas, como la radiación cósmica de fondo o los rayos X en el curso de las medidas de diagnóstico médico. La ruptura de las cadenas de ADN puede conducir a la muerte celular o a mutaciones y, por tanto, contribuir a largo plazo al desarrollo del cáncer o al proceso de envejecimiento.
Reparación del ADN por PARP1
Las células poseen herramientas moleculares para reparar esas roturas de cadenas de ADN de manera muy eficiente. Una de ellas es la enzima poli(ADP-ribosa) polimerasa 1 (PARP1), que detecta las rupturas de la cadena de ADN y, por lo tanto, inicia los procesos de reparación posteriores. Al unirse a la rotura de una cadena de ADN, la PARP1 se activa (catalíticamente) y utiliza el sustrato nicotinamida adenina dinucleótido (NAD+) para producir poli(ADP-ribosa) (PAR), un biopolímero en forma de cadena. Este sirve como un transmisor de señales en la célula y coordina la respuesta posterior al daño del ADN. En el curso posterior del proceso, el PARP1 se desprende de nuevo del lugar del daño, despejando así el camino para los pasos posteriores en la reparación del ADN. Este proceso es de importancia médica, más aún cuando recientemente se han introducido inhibidores farmacológicos de PARP1 en la terapia del cáncer.
Los científicos de la Universidad de Constanza (grupos de trabajo de los profesores Aswin Mangerich y Alexander Bürkle, del Departamento de Biología, y el grupo de trabajo de la profesora Karin Hauser, del Departamento de Química) han podido ahora visualizar en detalle los procesos bioquímicos que cumple la PARP1 en la ruptura de una cadena de ADN. Para ello, utilizaron un método especial de espectroscopia infrarroja (ATR-FTIR), que también se había utilizado con éxito en un estudio anterior, recientemente publicado, sobre las interacciones de la proteína supresora de tumores p53 con el ADN y la PAR.
Observaciones en tiempo real mediante espectroscopia infrarroja
"Lo especial de nuestro nuevo estudio es que ahora podemos investigar los procesos moleculares que el PARP1 experimenta en las roturas de la cadena de ADN en tiempo real. Esto nos ha permitido desvelar los cambios dinámicos en la estructura de la proteína y, por tanto, obtener más información sobre los mecanismos subyacentes", dijo la Dra. Annika Krüger, que trabajó en el proyecto como parte de su tesis doctoral, ya concluida con éxito. Durante la elaboración de su tesis doctoral, Krüger contó con el apoyo de la Escuela de Investigación de Biología Química, el Zukunftskolleg de la Universidad de Constanza y el Centro de Investigación en Colaboración de Constanza 969 "Principios químicos y biológicos de la proteostasis celular". Actualmente está realizando investigaciones en el renombrado Instituto Karolinska de Estocolmo (Suecia).
Como cuestión de principio, este método espectroscópico puede utilizarse para investigar también otros procesos enzimáticos que tienen lugar en el ADN, en detalle y con resolución molecular. A largo plazo, esto puede contribuir a una mejor comprensión de los mecanismos de desarrollo y envejecimiento del cáncer, así como del modo de acción de los medicamentos contra el cáncer.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.





































