Develada una malformación asociada a la epilepsia grave
Un estudio apunta que la desregulación del gen NEUROG2 estaría relacionada con el surgimiento de displasia cortical focal, una de las causas más comunes de la epilepsia refractaria a medicamentos
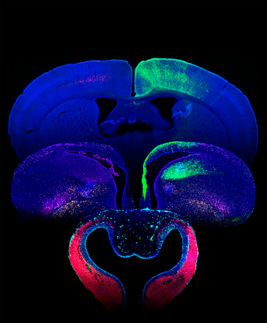
Una de las causas más comunes de epilepsia refractaria al tratamiento farmacológico - una enfermedad de difícil control - es una malformación cerebral conocida con el nombre de displasia cortical focal.
Los pacientes acometidos por este problema exhiben una discreta desorganización en la arquitectura de una región específica de la corteza cerebral, que puede estar asociada o no a la presencia de células nerviosas con una estructura y un funcionamiento anormal.
Un nuevo estudio realizado en la Universidad de Campinas (Unicamp), en Brasil, sugiere que la desregulación en la expresión de un gen llamado NEUROG2, que es importante en el proceso de diferenciación de las neuronas y también en el de las células de la glía (astrocitos, oligodendrocitos y microglías), desempeñaría un papel clave en el desarrollo de la enfermedad.
"Demostramos que en el tejido cerebral de los pacientes con displasia cortical focal la expresión del microARN hsa-miR-34a se encuentra disminuida, y esto parece resultar en la sobreexpresión del gen NEUROG2. Creemos que este factor puede estar asociado a fallas en el proceso de diferenciación de las células nerviosas", comentó Iscia Lopes-Cendes, docente de la Facultad de Ciencias Médicas de la Unicamp y directora de la investigación.
Este estudio se llevó a cabo durante el doctorado de Simoni Avansini, en el ámbito del Instituto Brasileño de Neurociencia y Neurotecnología (BRAINN, uno de los Centros de Investigación, Innovación y Difusión (CEPIDs) que cuentan con el apoyo de la Fundación de Apoyo a la Investigación Científica del Estado de São Paulo - FAPESP. Y sus resultados se dieron a conocer recientemente en el periódico científico Annals of Neurology.
"Nuestros hallazgos se basan en el análisis de tejidos cerebrales de 16 pacientes con displasia cortical focal tipo II, que es cuando además de la desorganización cortical también aparecen células nerviosas aberrantes, entre ellas las neuronas dismórficas, que permanecen en un constante estado de excitación y por eso favorecen las crisis epilépticas", explicó Lopes-Cendes.
En esos casos, añadió la científica, la remoción quirúrgica del área malformada del cerebro constituye la única estrategia disponible para controlar los síntomas de la epilepsia. Pero eso sólo es posible cuando no se trata de zonas importantes del cerebro, tales como las asociadas a la visión, la audición, el habla y las restantes funciones esenciales del organismo.
Según Lopes-Cendes, alrededor del 25% de los pacientes con epilepsia refractaria y con recomendación de cirugía padecen displasia cortical focal. Pero entre los niños dicho porcentaje es mucho más alto, y esta malformación en la corteza constituye la principal causa de epilepsia de difícil control en la infancia.
Estudios anteriores asociaron el surgimiento de la displasia cortical focal a mutaciones en una vía de señalización celular mediada por la proteína mTOR (diana de rapamicina en mamíferos, por sus siglas en inglés), que lleva a una proliferación anormal de células cuando se encuentra hiperactiva. Con todo, estas mutaciones somáticas (presentes en el tejido displásico, pero no así en las restantes células de los pacientes) aparecieron en un cuarto de los afectados por la enfermedad; por ende, no explican por sí solas todos los casos de malformación cerebral.
En la muestra que analizó el grupo de Lopes-Cendes, el 28% de los pacientes con displasia exhibían mutaciones somáticas en la vía de la mTOR.
La regulación mediante microARNs
Con el objetivo de descubrir otras posibles causas de la malformación cerebral, los científicos decidieron realizar un análisis de la expresión de microARNs -o miARNs, pequeñas moléculas de ARN que no contienen información para la síntesis de proteínas, pero que son capaces de unirse a genes codificadores y modular su expresión- en los tejidos extraídos de pacientes atendidos en el Hospital de Clínicas de la Unicamp.
Mediante el empleo de una técnica conocida como microarray, se analizó un conjunto de 800 microARNs. La idea era identificar en forma indirecta genes importantes para el desarrollo cerebral que podrían estar desregulados en el tejido displásico. Los resultados se compararon con los de personas que no padecían la enfermedad sometidas a autopsia (grupo de control).
"Notamos una diferencia en la expresión tan sólo de tres microARNs: hsa-let-7f, hsa-miR-31 y hsa-miR-34. Por eso investigamos con técnicas de bioinformática con qué genes podrían estar interactuando estas moléculas. Y llegamos a una lista de diez genes posibles", dijo Lopes-Cendes.
El grupo analizó entonces la expresión de esos diez genes sospechosos en los tejidos de los 16 pacientes y del grupo de control y arribó a la conclusión de que tan sólo NEUROG2 se encontraba sobreexpresado en el grupo con displasia cortical focal.
"Al unirse al gen, el microARN inhibe su expresión. Por ende, cuando la expresión del microARN se encuentra disminuida, el gen aparece más activo. Es una regulación al contrario. Como NEUROG2 parece ser un gen importante para el desarrollo del cerebro, decidimos profundizar los análisis", comentó Lopes-Cendes.
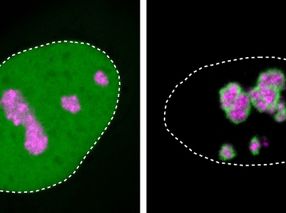
Al combinar dos técnicas distintas -PCR (reacción en cadena de la polimerasa) e hibridación in situ- el grupo de la Unicamp logró demostrar que NEUROG2 exhibía efectivamente una expresión aumentada, y precisamente en las células nerviosas aberrantes halladas en el tejido displásico, tanto en las neuronas dismórficas como en las células balonadas, que exhiben marcadores de células madre, de neuronas y de células de la glía.
Para comprobar que el aumento en la expresión estaba relacionado con la disminución en hsa-miR-34a, el grupo realizó los llamados ensayos de unión. Los resultados de este experimento demostraron que el microARN es efectivamente capaz de unirse a una zona importante del gen NEUROG2 e inhibir su actividad.
"Resolvimos entonces avanzar un poco más en la investigación y demostramos que en los tejidos de los pacientes displásicos el gen RND2 -que es regulado por NEUROG2 e integra la misma vía de señalización- también está sobreexpresado. Esto no se observó en el tejido de control", comentó Lopes-Cendes.
Datos existentes en la literatura científica indican que la vía de NEUROG2 es importante para regular el proceso de diferenciación de las células nerviosas. De acuerdo con Lopes-Cendes, durante el desarrollo embrionario, primeramente debe concretarse un proceso de neurogénesis (formación de nuevas neuronas) y luego la gliogénesis (la formación de células gliales).
"Creemos que con el NEUROG2 sobreexpresado esta transición de la neurogénesis a la gliogénesis no transcurre en la forma adecuada, pues la señal que estimula la neurogénesis permanece activa cuando ya no debería estarlo. Esta desregulación perdura en el tejido displásico desde el desarrollo embrionario hasta la vida adulta", dijo la investigadora.
Aún resta descubrir qué podría causar la merma de la expresión de hsa-miR-34 en esos pacientes. A juicio de Lopes-Cendes, la explicación de ello podría estar relacionada tanto con factores genéticos (polimorfismos y mutaciones) como epigenéticos (factores ambientales que alteran la expresión génica sin modificar el ADN).
"Es posible que la desregulación de hsa-miR-34 esté relacionada con un factor ambiental, tal como es el caso de una infección viral durante la gestación, por ejemplo. Son hipótesis que aún deberán ponerse a prueba en futuras investigaciones", dijo.