Neue Entdeckung in der Enzymforschung: Wasser als Schlüssel zur Aktivität
Entdeckung könnte helfen, Biokatalysatoren gezielter für industrielle Anwendungen wie Lebensmittelverarbeitung und Biokraftstofferstellung einzusetzen
Anzeigen
Forschende der Universität Greifswald haben eine Besonderheit bei Enzymen entdeckt, die an der Umsetzung von Zuckermolekülen beteiligt sind. Sie identifizierten ein präzise eingebundenes Wassermolekül. Diese Entdeckung könnte langfristig dabei helfen, Biokatalysatoren gezielter für industrielle Anwendungen wie der Lebensmittelverarbeitung oder zur Herstellung von Biokraftstoffen einzusetzen. Die Ergebnisse erschienen am 31. Juli 2025 in Nature Communications.
Kohlenhydrat-Esterasen, also Biokatalysatoren, die komplexe Zuckerstrukturen verändern, indem sie bestimmte chemische Gruppen entfernen, nahmen Biochemiker*innen rund um Prof. Dr. Uwe Bornscheuer vom Institut für Biochemie in den Blick. Kohlenhydrat-Esterasen beeinflussen, wie gut andere Enzyme diese Zucker weiterverarbeiten können. Zwei Vertreter der Enzymfamilie CE20, Fl8CE20_II und PpCE20_II, wurden nun erstmals in ihrer vollständigen Struktur mithilfe von Röntgenkristallographie im Rahmen der DFG-geförderten Forschungsgruppe POMPU und in Zusammenarbeit mit Wissenschaftlern aus Brasilien entschlüsselt und deren Funktion im Detail aufgeklärt.
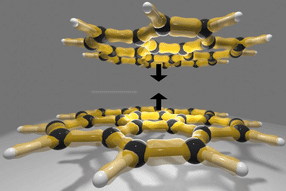
Dabei stießen die Forschenden auf eine überraschende Besonderheit im sogenannten aktiven Zentrum der Enzyme, also dem Teil, der die chemischen Reaktionen ausführt. „Normalerweise besteht dieses Zentrum aus drei genau platzierten Aminosäuren, die zusammenarbeiten – eine sogenannte ‚katalytische Triade‘. In den untersuchten Enzymen fehlte jedoch ein entscheidender Bestandteil: Statt einer direkt beteiligten Aminosäure haben wir ein präzise eingebundenes Wassermolekül identifiziert, das die Funktion übernehmen kann“, erklärt Michelle Teune, Doktorandin an der Universität Greifswald, die zusammen mit Plinio Vieira Erstautorin der Studie ist.
Diese neu entdeckte Struktur – eine „wasservermittelte katalytische Triade“ – wurde durch gezielte Experimente bestätigt. Verschiedene Mutanten des Enzyms wurden untersucht, um deren Einfluss auf die Koordination des Wassermoleküls zu prüfen. Demnach spielt das Wassermolekül in dieser neuartigen Triade eine zentrale Rolle für die Aktivität der Enzyme. „Unsere Ergebnisse zeigen, dass Wasser hier nicht nur als Lösungsmittel dient, sondern aktiv an der Reaktion beteiligt ist“, erklärt Prof. Michael Lammers, der als Strukturbiologe am Institut für Biochemie an der Studie beteiligt ist und ergänzt: „Dies ist ein so bislang nicht bekannter Mechanismus, der unser Verständnis von Enzymen fundamental erweitert.“
„Diese Studie zeigt, wie vorteilhaft wissenschaftliche Kooperationen sind und liefert wichtige Grundlagen zum Verständnis von Kohlenhydrat-Esterasen auch für den gerade von der DFG bewilligten Transregio/SFB CONCENTRATE“, so Prof. Dr. Uwe Bornscheuer, leitender Forscher dieses Projektes.
Diese neuen Erkenntnisse sind nicht nur für die Grundlagenforschung wichtig, sondern können auch praktische Anwendungen finden, da mithilfe dieser Biokatalysatoren aus terrestrischen und marinen Kohlenhydraten nachhaltig wertvolle Produkte für verschiedene Anwendungen im Lebensmittelbereich oder in der Biotechnologie beispielsweise zur Herstellung von Biokraftstoffen gewonnen werden können.
Originalveröffentlichung
Michelle Teune, Plínio S. Vieira, Thorben Döhler, Gottfried J. Palm, Theresa Dutschei, Daniel Bartosik, Leona Berndt, Gabriela F. Persinoti, Sandra Maaß, Dörte Becher, Thomas Schweder, Mário T. Murakami, Michael Lammers, Uwe T. Bornscheuer; "Insights into a water-mediated catalytic triad architecture in CE20 carbohydrate esterases"; Nature Communications, Volume 16, 2025-7-31