Umschaltbares Bakterizid
Nanomaterial mit „Lichtschalter“ tötet Gram-negative oder Gram-positive Bakterien ab
Anzeigen
Krankenhauskeime sind häufig ein Problem bei schwärenden Wunden. Um selektiv Gram-negative oder Gram-positive Krankenhauskeime wirksam zu bekämpfen, hat nun eine Forschungsgruppe eine bakterizides Nanomaterial mit einem chemischen „Lichtschalter“ versehen. Die Wirkungsweise wird durch UV- und sichtbares-Licht umgestellt, und die starke Wirksamkeit gegen den Gram-positiven Krankenhauskeim MRSA kann auf andere bakterielle Infektionen übertragen werden, zeigt die in der Fachzeitschrift Angewandte Chemie veröffentlichte Studie.
© Wiley-VCH
Antibiotikaresistente Keime haben sich in Krankenhäusern zu einem ernsthaften Gesundheitsproblem entwickelt. Viele dieser Bakterienarten sind in der Umwelt weit verbreitet, können aber bei immungeschwächten Patient*innen schwere Infektionen verursachen. Neben Antibiotika bieten bakterizide Materialien einen Ansatz, um Krankenhauskeime zu bekämpfen. Mrinmoy De und Kollegen vom Indian Institute of Science in Bengaluru (Indien) haben nun ein Nanomaterial hergestellt, das durch Einstrahlung von UV-/sichtbarem Licht seine Wirkungsweise umschaltet und dadurch sowohl Gram-positive als auch Gram-negative Keime angreifen kann.
Beide Bakterientypen haben eine unterschiedlich strukturierte und zusammengesetzte Außenhülle. Bei Gram-positiven Bakterien, wozu der der Krankenhauskeim Methicillin-resistenter Staphylococcus aureus (MRSA) gehört, besteht die Bakterienmembran zum großen Teil aus Peptidoglykanen. Gram-negative Bakterien wie Pseudomonas aeruginosa, ebenfalls ein Krankenhauskeim mit einer problematischen Resistenz gegen Breitband-Antibiotika, haben hingegen eine äußere und innere Membran hauptsächlich aus Phospholipiden mit einer dünnen Peptidoglykan-Zwischenschicht. „Es ist wichtig, eine bakterizide Aktivität zu erreichen, die selektiv auf die Bakterienstämme wirkt“, erklärt De.
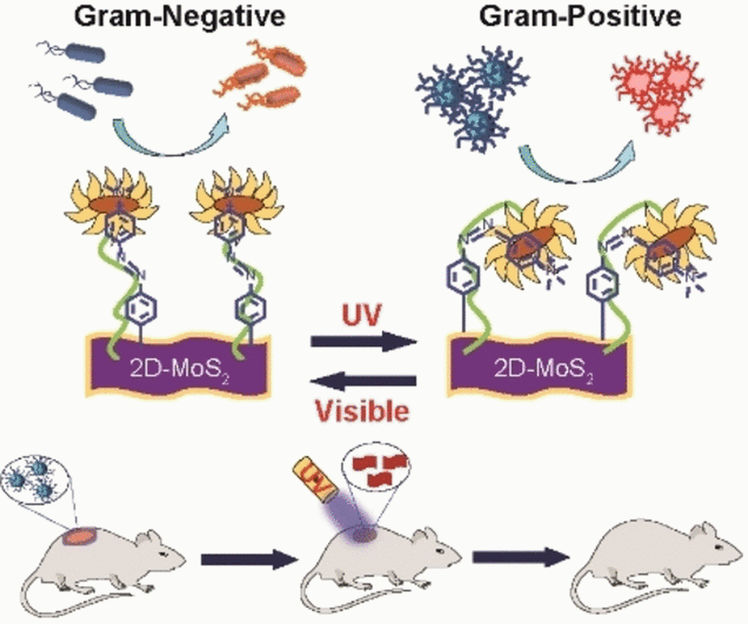
Um ein Bakterizid herzustellen, dass selektiv beide chemischen Außenhüllvarianten angreift, funktionalisierte das Forschungsteam ein Nanomaterial aus Molybdändisulfid (MoS2), einem bakteriziden Grundstoff, mit Azobenzoleinheiten, die eine quartäre, positiv geladene Aminogruppe trugen. Während die quartäre Aminogruppe durch die positive Ladung die Bakterienmembran depolarisieren kann, reagieren die Azobenzoleinheiten auf Einstrahlung von UV-Licht mit einem Umschalten von der gestreckten Trans- in eine gekrümmte Cis-Form.
Durch Tests mit chemischen Sonden und durch optische Messungen stellte das Team fest, dass sowohl die Cis- als auch die Trans-Form des Nanomaterials die Bakterien abtötete, jedoch auf höchst unterschiedliche Weise. Im Falle des Gram-negativen P. aeruginosa depolarisierte die Transform die Bakterienmembran und durchlöcherte sie regelrecht. Das MoS2-Nanomaterial drang ein und tötete die Bakterien ab. Umgekehrt reagierte der Gram-positive MRSA-Stamm stärker auf die Cisform. Diese schädigte und zersetzte die Zellwand durch spezifische Wechselwirkungen.
Nur durch Umlegen des UV-Lichtschalters steuerte das Team demnach die Selektivität gegenüber der beiden Bakterientypen. Die zuverlässige Wirkung demonstrierte das Team durch eine erfolgreiche Wundheilung bei Mäusen, denen eine MRSA-infizierte Wunde beigebracht wurde. Die Wunde verschloss sich nach 10 Tagen vollständig bei Behandlung mit dem Cis-Reagenz, während die übliche Antibiotikabehandlung mit Vancomycin viel länger dauerte.