Sehen, riechen, schmecken: Wie Biomoleküle in Sinneszellen funktionieren
Mit einer einzigen Messung irreversible Prozesse untersuchen
Anzeigen
Ein Team hat analysiert, wie sich das Biomolekül Rhodopsin nach der Aktivierung durch Licht verändert. Rhodopsin spielt beim Sehen eine zentrale Rolle, ist aber auch ein Prototyp für Rezeptoren in anderen Sinnesorganen. Ein neu entwickeltes Infrarotspektrometer an BESSY II hat es ermöglicht, diese Untersuchung erstmals unter natürlichen Bedingungen durchzuführen. Mit der neuen Methode lassen sich schnelle, irreversible Reaktionen mit nur einer einzigen Messung beobachten. Bislang mussten dafür tausende solcher Reaktionen ausgewertet werden. Viele biologische Prozesse sind jedoch irreversibel und lassen sich nicht zyklisch wiederholen.
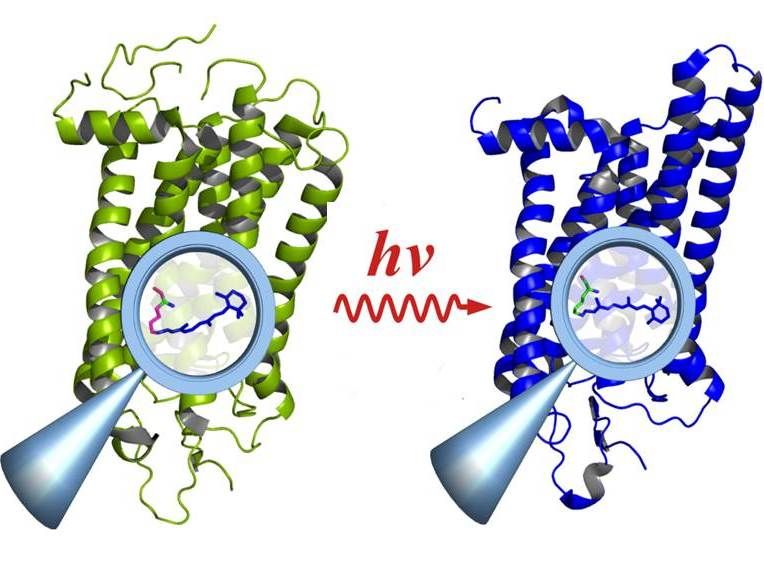
Rhodopsin vor der Aktivierung durch Licht (links) und danach (rechts): Die Anregung führt im Innern des Moleküls zu Änderungen an funktionalen Gruppen (Lupe), die sich auf das gesamte Molekül auswirken.
© E. Ritter/HZB
Zeitaufgelöste Infrarotspektroskopie im Submillisekunden-Bereich ist eine wichtige Methode, um die Beziehung zwischen Funktion und Struktur in Biomolekülen zu untersuchen. Dies funktioniert jedoch nur dann, wenn die Reaktion viele Tausende Mal wiederholt werden kann. Das ist aber bei einer Vielzahl von biologischen Prozessen nicht der Fall: Sie basieren vielmehr auf sehr schnellen und irreversiblen Reaktionen, beispielsweise in den Sinneszellen der Netzhaut beim Sehen.
Féry-Infrarotspektrometer: Eine einzige Messung reicht
Nun hat ein Team um Dr. Ulrich Schade (HZB) und Dr. Eglof Ritter (Humboldt-Universität zu Berlin) an der IRIS-Beamline von BESSY II ein neues Instrument entwickelt, das mit einer einzigen Messung auch solche irreversiblen Reaktionen erfassen kann. Die Zeitauflösung beträgt dabei wenige Mikrosekunden. Das Instrument, ein Féry-Spektrometer, nutzt einen hochempfindlichen Detektor (sog. Focal-Plane-Array-Detektor) und spezielle Optiken, um die brillante Infrarotstrahlung der Synchrotronquelle BESSY II optimal auszunutzen. Das Team konnte damit erstmals die Aktivierung von Rhodopsin unter nahezu physiologischen Bedingungen beobachten.
Nagelprobe für das System: Rhodopsin
„Wir haben Rhodopsin verwendet, da es nach Lichtanregung irreversibel zerfällt und somit eine echte Nagelprobe für das System ist“, erklärt Ritter, Erstautor der Studie. Das Protein Rhodopsin ist das Sehpigment in den Stäbchen der Netzhaut des Auges. Schon einzelne Photonen können Rhodopsin aktivieren - damit ermöglicht es die Wahrnehmung von geringsten Lichtintensitäten. Darüber hinaus ist Rhodopsin der Prototyp einer großen Klasse von Rezeptoren, die unter anderem für Riechen, Schmecken, Druckempfinden, Hormonrezeption usw. verantwortlich sind, und die alle auf eine sehr ähnliche Art und Weise funktionieren.
Das Team untersuchte außerdem ein weiteres spannendes Protein erstmals im Infrarotbereich: Actinorhodopsin. Dieses Molekül ist in der Lage, Lichtenergie in einen elektrischen Strom umzuwandeln – eine Eigenschaft, die sich manche Bakterien zur Gewinnung elektrochemischer Energie für ihren Stoffwechsel zu Nutzen machen.
„Mit der neuen Methode lassen sich die molekularen Reaktionsmechanismen aller irreversiblen Prozesse (oder langsam zyklischen Prozesse) untersuchen, zum Beispiel im Bereich der Energiekonversion und -Speicherung“, betont Schade, der das IRIS-Team leitet.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

























































