Türsteher für Giftkapsel
Forscher entschlüsseln Giftkomplex des Pesterregers und anderer Krankheitskeime
Anzeigen
Bakterien haben verschiedene Strategien entwickelt, um Organismen zu infizieren und als Nahrungsquellen zu nutzen. Viele Mikroben nutzen dafür membranzerstörende Gifte, die einfach nur die Außenhülle von Zellen durchlöchern. Krankheitserreger wie der Pesterreger Yersinia pestis oder Bakterien aus der Familie der Salmonellen gehen dagegen wesentlich subtiler vor. Sie setzen ein komplexes Toxin ein, dessen Wirkungsweise bis vor kurzem nicht erforscht war. Am Beispiel des Bakteriums Photorhabdus luminescens gelang einer Forschergruppe um Stefan Raunser vom Max-Planck-Institut für molekulare Physiologie in Dortmund nun die vollständige Enthüllung eines raffiniert konstruierten Mechanismus.
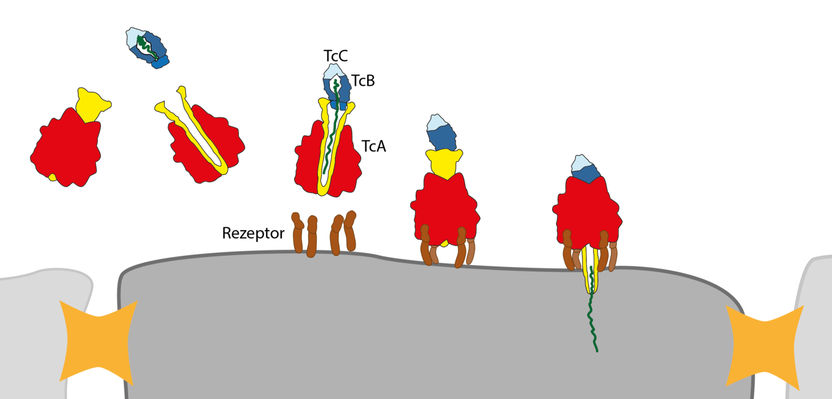
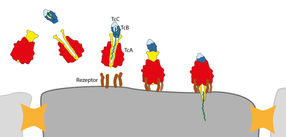
Der Giftkomplex wird von Rezeptoren (braun) auf der Zellmembran erkannt und gebunden. Der Kanal (gelb) der TcA Untereinheit drückt sich durch die Membran und der Giftstoff (grün) wird injiziert.
© MPI f. molekulare Physiologie
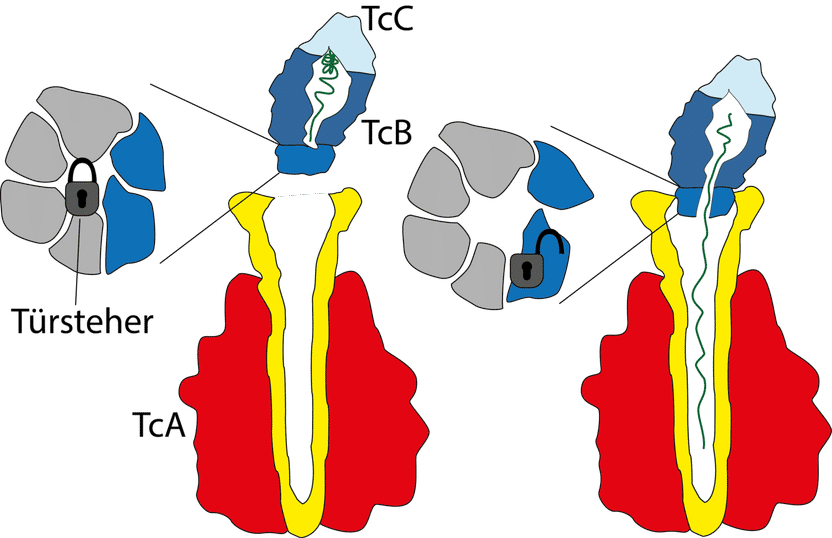
Der Giftkomplex besteht aus den drei Komponenten TcA (rot, gelb), TcB (dunkelblau) und TcC (hellblau). Die Giftkapsel (TcB-TcC) wird verschlossen von einem 6-blättrigen Propeller (grau, dunkelblau) mit einer zentralen Haarnadelstruktur, auch „Türsteher“ genannt (Schloss). Bindet die Giftkapsel an den Kanal (gelb) der TcA Untereinheit, dreht sich der Türsteher zur Seite und öffnet den Kanal. Der Giftstoff (grün) wird freigegeben.
© MPI f. molekulare Physiologie
Bakterielle Toxine gehören zu den wirksamsten Giften in der Natur. Zu den stärksten Toxinen zählen z.B. das Tetanus- und Botulinumtoxin (Botox), die bereits im Tausendstel-Gramm-Bereich ihre tödliche Wirkung entfalten. Bakterien haben unterschiedlichste Strategien und Mechanismen entwickelt, um ihre giftige Ladung in Organismen einzuschleusen. Das Bakterium Photorhabdus luminescens, sowie der Pesterreger Yersinia pestis und Krankheitserreger aus der Familie der Salmonellen setzen sogenannte Tc-Toxine ein, die aus mehreren Komponenten bestehen (TcA, TcB, TcC). Das Zusammenwirken dieser Untereinheiten war bis vor kurzem unbekannt.
Große Biomoleküle, wie die komplex aufgebauten bakteriellen Gifte, entziehen sich in den meisten Fällen der Strukturaufklärung mit der klassischen Röntgenkristallografie, da sie nicht in einen für dieses Verfahren notwendigen kristallinen Zustand überführt werden können. Für die Kryo-EM hingegen ist eine Kristallisierung der Proben nicht erforderlich. Große Komplexe lassen sich sogar im natürlichen Zustand abbilden, indem sie mit hoher Geschwindigkeit tiefgefroren und dann bei minus 196 Grad direkt im Mikroskop untersucht werden.
Das Team um Stefan Raunser nutzte diese Methode, um erstmals die dreidimensionale Struktur des Giftkomplexes aus Photorhabdus luminescens im Detail zu bestimmen. Demnach ähnelt die größte Untereinheit des Giftkomplexes, TcA, einer Glocke und bildet einen Kanal aus, der von einer Hülle umschlossen wird. Der obere Teil der Glocke bindet die Giftkapsel, geformt aus den Untereinheiten TcB und TcC. Der untere Teil der Glocke wird von Rezeptoren auf der Zellmembran erkannt und der beladene Giftkomplex gebunden.
Sobald sich der pH-Wert des umgebenden Mediums verändert, öffnet sich die äußere Hülle des Toxins und gibt den Kanal frei. Dann schnellt eine unter hoher Spannung stehende Proteinkette zurück, drückt den Kanal wie die Kanüle einer Spritze durch die Zellmembran und injiziert den Giftstoff. Dabei handelt es sich um ein Enzym, das die Verklumpung des Zellskeletts katalysiert und somit zum Tod der Zelle führt.
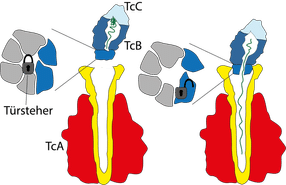
Molekularer Türsteher
Zum vollständigen Verständnis der Giftinjektion fehlte den Wissenschaftlern noch ein letztes Detail: nämlich, wie dieser Apparat kontrolliert wird. Dies gelang dem Dortmunder Team nun in Kooperation mit der Gruppe um Manajit Hayer-Hartl vom Max-Planck-Institut für Biochemie in Martinsried. Im Mittelpunkt der neuen Untersuchungen stand eine kleine Haarnadelstruktur, die auch als „Türsteher“ bezeichnet wird. Sie kontrolliert den Ausgang der Giftkapsel zum Kanal der TcA-Untereinheit - ein Tor, das einem sechsblättrigen Propeller ähnelt. Bindet die Kapsel an den Kanal, findet eine Umstrukturierung in diesem Grenzbereich statt: Der Türsteher dreht sich aus der Mitte des Propellers heraus und gibt die zentrale Öffnung frei, die nun passgenau an den Kanal der TcA-Untereinheit anschließt.
Die Wissenschaftler konnten auch zeigen, dass die Anwesenheit des Enzyms in der Giftkapsel entscheidend für die Bildung des gesamten Giftkomplexes ist. Sie vermuten dahinter einen Kontrollmechanismus, der garantieren soll, dass die TcA-Untereinheit ausschließlich mit einer vollen Giftkapsel beladen wird.
Auch heute noch sind bakterielle Infektionen eine der häufigsten Ursachen für Erkrankungen mit schweren Verläufen (z.B. Sepsis). Durch die intensive Nutzung von Antibiotika sind fatale Resistenzen entstanden, die den Kampf gegen humanpathogene Bakterien deutlich erschwert haben. Die Aufklärung bakterieller Infektionsmechanismen wird helfen, die Wirkungsweise von humanpathogenen Bakterien besser zu verstehen. Das neu gewonnene Verständnis über den außergewöhnlichen Mechanismus der Tc-Toxin-Injektion könnte als Ansatzpunkt für die Entwicklung innovativer Therapieansätze dienen.