L'enzyme au cœur de fer
Les résultats pourraient conduire à de nouveaux biocatalyseurs pour une biotechnologie durable
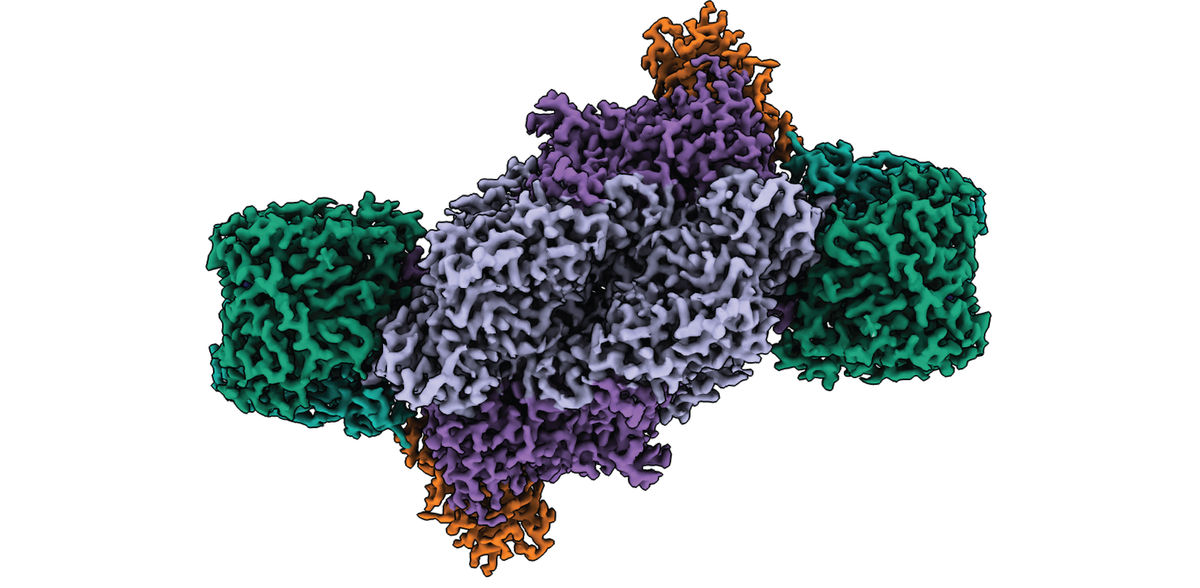
Les nitrogénases sont les seules enzymes capables de réduire l'azote atmosphérique en azote biodisponible (ammoniac), un processus essentiel à toute vie sur Terre. Grâce à la microscopie électronique cryogénique, des chercheurs de l'Institut Max Planck de microbiologie terrestre de Marburg, en Allemagne, ont maintenant résolu la structure complète du complexe de la nitrogénase à base de fer et révélé son architecture moléculaire unique. Leurs résultats jettent les bases d'une meilleure compréhension des relations structure-fonction de cette importante enzyme et pourraient contribuer au développement de nouveaux biocatalyseurs pour l'assimilation durable de l'azote et la conversion duCO2.
L'azote fait partie de nombreuses biomolécules importantes, telles que les bases de notre ADN et les acides aminés qui composent les protéines et les enzymes. Pour que l'azote puisse faire partie des biomolécules, il doit être activé. Dans la nature, seule une classe d'enzymes, les nitrogénases, peut effectuer cette catalyse vitale.
Les nitrogénases peuvent également transformer leCO2
Récemment, il a été démontré que les nitrogénases peuvent également réduire le dioxyde de carbone (CO2) et le monoxyde de carbone en hydrocarbures, comme le méthane ou l'éthylène, ce qui offre en principe un moyen de recycler les déchets de carbone en produits hydrocarbonés. Au sein de la famille des nitrogénases, la nitrogénase à fer (Fe) est l'isoenzyme qui présente l'activité naturelle de réduction duCO2 la plus élevée. Toutefois, l'architecture moléculaire qui permet ces réactions est restée inconnue, un problème que l'équipe du Dr Johannes Rebelein, de l'Institut Max Planck de microbiologie terrestre, s'est efforcée de résoudre.
En utilisant comme organisme modèle une variante modifiée de la bactérie pourpre non sulfureuse Rhodobacter capsulatus, les chercheurs ont purifié et caractérisé biochimiquement la Fe nitrogenase. En combinant la biochimie anaérobie et la microscopie électronique cryogénique en collaboration avec l'installation centrale de microscopie électronique de l'Institut Max Planck de biophysique à Francfort, ils ont maintenant résolu la structure de l'ensemble du complexe Fe Nitrogenase.
Les résultats montrent que le cofacteur du site actif, contrairement à d'autres types de nitrogénases, ne contient pas d'autre métal que le fer. En outre, l'architecture de la Fe Nitrogenase révèle des propriétés structurelles distinctes qui peuvent être responsables des propriétés catalytiques uniques de la Fe Nitrogenase.
Des différences qui vont au-delà du centre actif
"Nous nous attendions à ce que la principale différence entre la nitrogénase à Fe et d'autres formes de nitrogénase, comme la nitrogénase à molybdène, soit l'architecture du cofacteur du site actif et son environnement immédiat. Nous avons été surpris de constater qu'en dépit des différences dans leurs propriétés catalytiques, les sites actifs des trois isoformes de la nitrogénase sont en fait très similaires", explique Frederik Schmidt, doctorant dans le laboratoire de Johannes Rebelein et coauteur de l'étude. Mais s'il n'y a pas de différences frappantes autour du site actif, quelles sont les caractéristiques qui pourraient expliquer la réactivité unique de cette enzyme ?
Les chercheurs pointent du doigt deux caractéristiques structurelles : Premièrement, l'enzyme possède une sous-unité supplémentaire appelée sous-unité G. Bien que cette sous-unité ait déjà été décrite, sa fonction est restée insaisissable. Sur la base de leur nouvelle structure, les chercheurs de Max Planck proposent trois fonctions possibles pour la sous-unité G, notamment la coordination du transfert d'électrons, la canalisation du substrat et la stabilisation du cofacteur du site actif.
Une réactivité accrue grâce à une symétrie modifiée
Les nitrogases sont des enzymes dont la fonction est assurée par l'interaction de deux moitiés symétriques. Cependant, lorsque les chercheurs ont superposé la structure de la Fe-nitrogenase à la structure déjà résolue de la Mo-nitrogenase, ils ont constaté que la symétrie de cette dernière était différente. "On suppose que les deux moitiés symétriques communiquent entre elles afin de coordonner le mécanisme catalytique de l'enzyme. La symétrie modifiée que nous avons observée dans la Fe nitrogenase pourrait expliquer sa réactivité particulière", explique Luca Schulz, coauteur de l'étude.
La question de savoir comment ces différences structurelles influencent exactement le mécanisme catalytique de la Fe nitrogenase sera une question clé pour l'avenir. Les chercheurs espèrent élucider davantage le mécanisme moléculaire de l'enzyme, ce qui pourrait contribuer au développement de nouveaux biocatalyseurs pour l'assimilation durable de l'azote et la conversion duCO2.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.