Un laser à rayons X découvre la structure d'un insecticide naturel contre les moustiques
Une protéine bactérienne agit contre un plus grand nombre d'espèces de moustiques qu'on ne le pensait auparavant
Une équipe de recherche internationale a analysé une toxine produite naturellement contre les insectes avec une précision atomique en utilisant le laser à rayons X le plus puissant au monde. Les données obtenues au laser européen XFEL permettent de comprendre le mode d'action de l'insecticide, qui est produit par une bactérie. Ces informations peuvent éventuellement conduire au développement de variantes personnalisées de l'insecticide, mieux adaptées à des insectes destructeurs spécifiques, tels que les moustiques qui agissent comme vecteurs de maladies. L'équipe, dirigée par Dominik Oberthür à DESY et Colin Berry à l'université de Cardiff au Royaume-Uni, présente ses résultats dans les Proceedings of the National Academy of Sciences(PNAS).
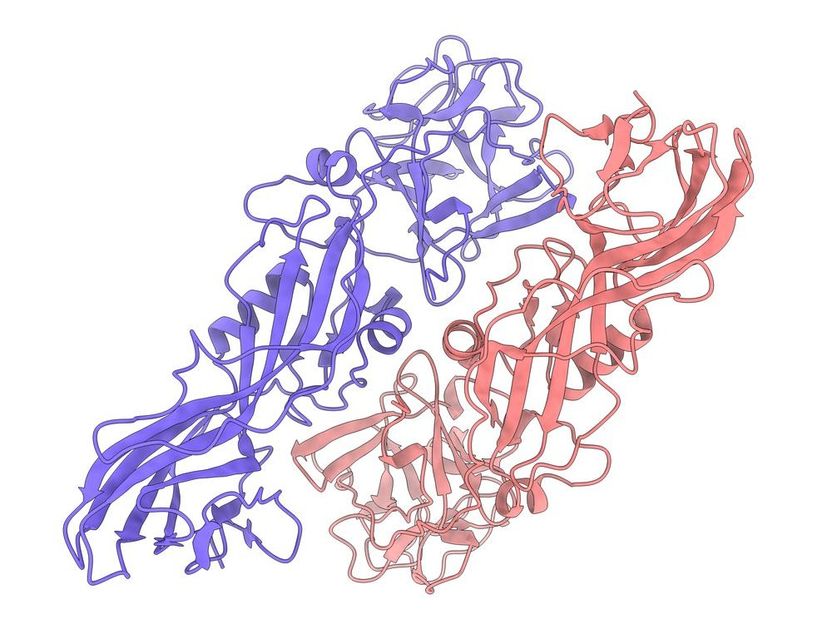
La structure de la protéine insecticide naturelle Tpp49Aa1. La structure a été déterminée par l'analyse des nanocristaux naturels formés par l'organisme qui génère la protéine, la bactérie Lysinibacillus sphaericus.
D. Oberthür, DESY
La protéine insecticide analysée s'appelle Tpp49Aa1 et est produite par la bactérie du sol Lysinibacillus sphaericus. Elle était connue pour être toxique, en combinaison avec une autre protéine appelée Cry48, pour le moustique domestique Culex quinquefasciatus, qui propage plusieurs agents pathogènes tels que les virus Zika et du Nil occidental. "L'insecticide fonctionne en fait sur un plus grand nombre d'espèces de moustiques que ce que nous pensions au départ, comme l'a montré notre enquête", rapporte le biochimiste Berry. Dans le cadre de cette étude, les collaborateurs du projet ont également testé la toxine sur différentes espèces de moustiques. Ils ont découvert que Tpp49Aa1, en combinaison avec Cry48, a également un effet toxique sur le moustique de la malaria Anopheles stephensi, le moustique tigre asiatique Aedes albopictus et le moustique de l'encéphalite occidentale Culex tarsalis, originaire de Californie.
"Les informations sur la structure détaillée de la toxine révèlent des indices sur la manière dont elle peut s'attacher à l'organisme pour produire son effet", explique Oberthür. "Cela ouvre la possibilité de la modifier pour qu'elle se lie de manière encore plus spécifique à un site d'interaction sur une espèce particulière". Ce n'est pas seulement intéressant pour la lutte contre les vecteurs de maladies, mais aussi pour l'agriculture, où plusieurs toxines bactériennes sont utilisées depuis longtemps et où un vaste marché s'est développé. Dans les deux cas, la toxine doit agir le plus spécifiquement possible sur l'insecte nuisible ciblé et épargner tous les autres organismes.
Afin de dériver la structure de la protéine, les chercheurs ont utilisé de minuscules cristaux de protéines produits par la bactérie elle-même. Ces cristaux sont généralement plus petits qu'un demi-millième de millimètre. Pour éclairer ce type de cristaux, il faut une lumière extrêmement brillante et cohérente de rayons X à impulsions courtes, que seul un laser à rayons X peut générer. La lumière des rayons X est diffusée par le cristal et le motif qui en résulte permet de calculer la structure des éléments constitutifs du cristal - dans ce cas, les protéines de la toxine.
Pour obtenir une image complète de la protéine, le cristal doit être éclairé de tous les côtés. Cependant, la lumière laser à rayons X incidente détruit immédiatement le cristal. C'est pourquoi les chercheurs utilisent une technique appelée cristallographie femtoseconde en série, dans laquelle une multitude de cristaux sont analysés et les résultats sont combinés en une seule image. Plus le nombre de données est élevé, plus la précision de l'analyse est grande. Grâce à la fréquence de répétition extrêmement élevée du XFEL européen, l'équipe a pu combiner des images prises à partir d'environ deux millions de cristaux minuscules dans sa station d'expérimentation SPB/SFX. Les calculs ont permis d'obtenir une image détaillée de la protéine avec une résolution de 0,162 nanomètre (un nanomètre est un millionième de millimètre), ce qui correspond au diamètre d'un seul atome de carbone.
"Les insecticides naturels pourraient jouer un rôle clé dans la lutte contre les maladies ou peut-être dans la protection des récoltes contre les parasites", explique Oberthür. "Grâce aux impulsions extrêmement lumineuses et intenses du laser à rayons X, nous avons pu étudier des cristaux non modifiés de l'insecticide et décrire leur structure. Cela pourrait aider à l'avenir à élucider la façon dont la résistance aux insecticides se développe chez les insectes".
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.




































