Comment les biomolécules réagissent à la lumière UV
Une expérience innovante révèle la dynamique ultrarapide des protéines dans leur environnement
Une expérience sophistiquée permet de mieux comprendre les réactions ultrarapides des biomolécules lorsqu'elles sont exposées à une lumière ultraviolette énergétique dans leur environnement naturel. L'équipe de Jochen Küpper, chercheur à DESY, a enregistré les processus induits par la lumière qui ont lieu dans un petit complexe de deux molécules servant de système modèle pour les interactions entre les protéines et les molécules de solvant environnantes, généralement de l'eau. Cette expérience constitue une étape importante sur la voie de l'enregistrement d'un "film moléculaire" de ces réactions chimiques, comme le rapporte l'équipe dans la revue Nature Communications. Küpper est le scientifique principal de DESY pour l'imagerie moléculaire contrôlée.
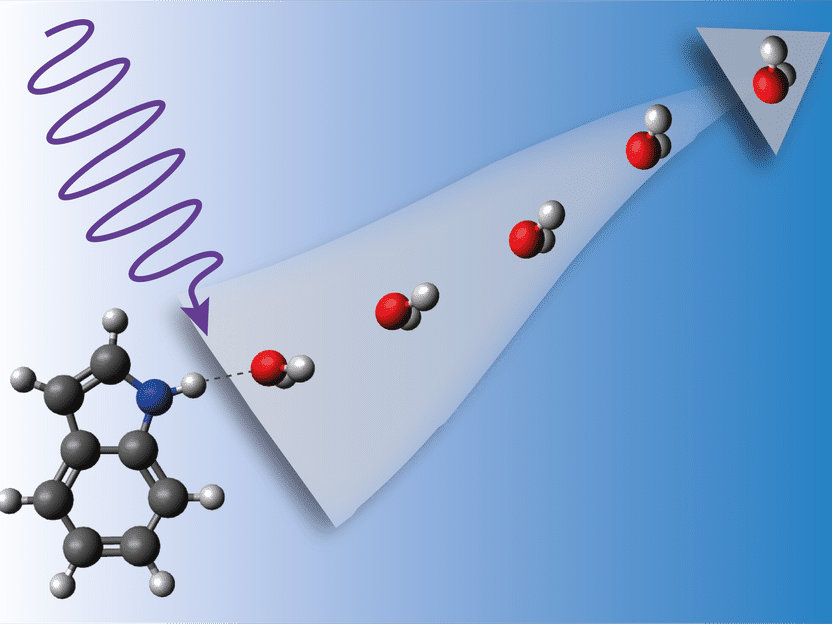
Lorsque le complexe indole-eau est touché par une lumière UV énergétique, il se met à vibrer violemment jusqu'à ce que l'eau se détache.
Radboud-Universität, Jolijn Onvlee
"Dans notre corps, les protéines se trouvent généralement dans un environnement aqueux, où les protéines individuelles sont entourées de molécules d'eau", explique l'auteur principal, Jolijn Onvlee, qui travaille désormais comme professeur adjoint à l'université Radboud aux Pays-Bas. Les interactions entre la protéine et les molécules de solvant (eau) qui l'entourent influent sur la façon dont les protéines se replient et donc sur leur fonction. "Nous avons spécifiquement étudié la dynamique ultrarapide induite par la lumière UV de modèles de protéines dans un environnement aqueux dans une approche ascendante en utilisant un petit agrégat d'un chromophore, une molécule qui absorbe la lumière et est donc excitée, avec une seule molécule d'eau attachée", rapporte Onvlee.
Les scientifiques ont choisi comme système modèle le composé aromatique indole (C8H7N), qui est le chromophore de l'acide aminé tryptophane et qui est donc présent dans presque toutes les protéines. Pour étudier les interactions entre les protéines et leur solvant environnant, les scientifiques ont attaché de l'eau aux molécules d'indole. Cependant, l'indole peut se lier à plusieurs molécules d'eau. Pour isoler les composés composés d'exactement une molécule d'indole et une molécule d'eau, l'équipe a utilisé un déflecteur électrostatique qui disperse les composés dans différentes directions en fonction du nombre de molécules d'eau attachées.
Les scientifiques ont envoyé des impulsions d'un laser UV sur les agrégats indole-eau. Ces agrégats absorbent la lumière UV, après quoi une dynamique complexe se produit à l'échelle de la femtoseconde (quadrillionième de seconde) et de la picoseconde (trillionième de seconde). Un second laser a été utilisé pour enregistrer les produits de la réaction sur un détecteur d'images. En modifiant le délai entre les deux lasers, des instantanés de la dynamique ultrarapide ont pu être réalisés à différents stades, révélant le déroulement des événements. "Lorsque la lumière UV frappe le complexe, la dynamique de l'état excité se produit d'abord, et après la relaxation électronique, le système commence à vibrer vigoureusement", explique Küpper. "La molécule d'indole se sent totalement chaude". Finalement, elle se détache de l'eau.
"Grâce à la combinaison du déflecteur électrostatique et de l'imagerie à résolution temporelle, nous avons pu démêler ces processus ultrarapides qui se déroulent dans le complexe", explique Küpper. À terme, nous aimerions enregistrer un "film moléculaire" à résolution atomique dans lequel nous verrions réellement le parcours de l'eau quittant la molécule d'indole. La présente recherche nous rapproche considérablement de cet objectif."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.