Les nœuds protéiques les plus complexes
Des physiciens théoriques mettent à l'épreuve l'intelligence artificielle AlphaFold de Google et découvrent les nœuds protéiques les plus complexes à ce jour
Depuis plus d'un demi-siècle, la question de savoir comment la composition chimique d'une protéine, la séquence d'acides aminés, détermine sa structure en 3D est l'un des plus grands défis de la biophysique. Ces connaissances sur ce que l'on appelle le "repliement" des protéines sont très demandées, car elles contribuent de manière significative à la compréhension de diverses maladies et à leur traitement, entre autres. C'est pour ces raisons que l'équipe de recherche DeepMind de Google a développé AlphaFold, une intelligence artificielle qui prédit les structures 3D.
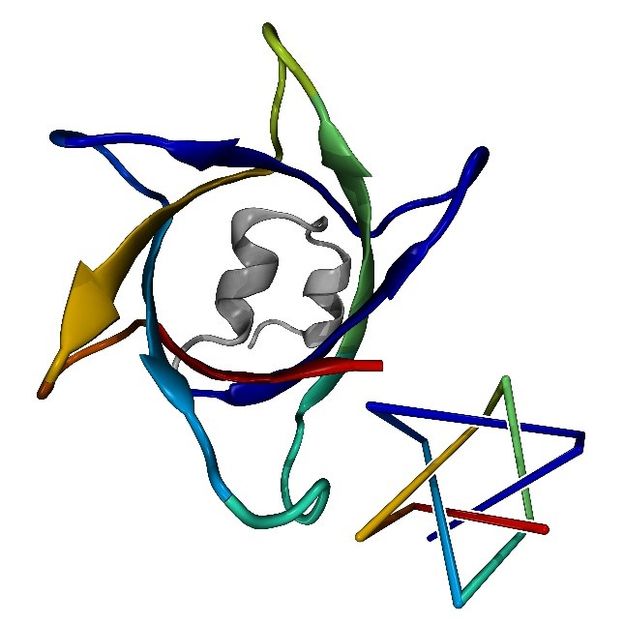
Le nœud protéique le plus complexe avec sept croisements (à gauche) prédit par AlphaFold et une représentation simplifiée (à droite).
© Maarten Brems
Une équipe composée de chercheurs de l'Université Johannes Gutenberg de Mayence (JGU) et de l'Université de Californie, Los Angeles, s'est penchée sur ces structures et les a examinées sous l'angle des nœuds. Nous connaissons les nœuds principalement grâce aux lacets de chaussures et aux câbles, mais ils apparaissent également à l'échelle nanométrique dans nos cellules. Les protéines nouées peuvent non seulement être utilisées pour évaluer la qualité des prédictions de structure, mais aussi soulever des questions importantes sur les mécanismes de repliement et l'évolution des protéines.
Les nœuds les plus complexes comme test pour AlphaFold
"Nous avons examiné numériquement toutes les prédictions d'AlphaFold pour les nouveaux nœuds de protéines, soit environ 100 000," explique Maarten A. Brems, doctorant dans le groupe du Dr Peter Virnau à l'université de Mayence. L'objectif était d'identifier des structures rares et de haute qualité contenant des nœuds protéiques complexes et inconnus jusqu'alors, afin de fournir une base pour la vérification expérimentale des prédictions d'AlphaFold. L'étude a non seulement permis de découvrir la protéine à nœuds la plus complexe à ce jour, mais aussi les premiers nœuds composites dans les protéines. Ces derniers peuvent être considérés comme deux nœuds distincts sur la même corde. "Ces nouvelles découvertes permettent également de mieux comprendre les mécanismes évolutifs à l'origine de protéines aussi rares", a ajouté Robert Runkel, un physicien théoricien également impliqué dans le projet. Les résultats de cette étude ont été récemment publiés dans Protein Science.
Le Dr Peter Virnau se réjouit de ces résultats : "Nous avons déjà établi une collaboration avec notre collègue Todd Yeates de l'UCLA pour confirmer ces structures de manière expérimentale. Cette ligne de recherche façonnera la vision de la communauté biophysique sur l'intelligence artificielle - et nous avons la chance d'avoir un expert comme le Dr Yeates impliqué."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.



































