Con hambre o lleno: Todo se reduce a los detalles atómicos
La estructura molecular de un receptor celular que regula el apetito
Una proteína de unos pocos nanómetros de tamaño actúa como un interruptor molecular que desempeña un papel crucial en la determinación de la sensación de hambre o saciedad. Al determinar la estructura tridimensional de la proteína, los investigadores de la Charité - Universitätsmedizin Berlin pudieron visualizar las estructuras moleculares de las hormonas con las que interactúa esta proteína, el receptor de melanocortina 4 (MC4R). Los investigadores informan en Cell Research que esto les permitió describir los mecanismos moleculares implicados en la activación e inhibición del receptor.
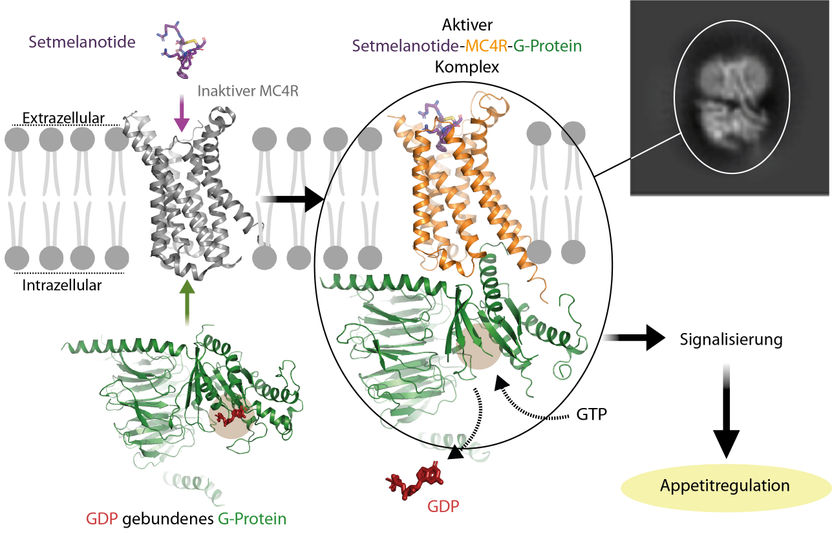
Activación del receptor MC4R acoplado a la proteína G por el fármaco setmelanotida. La imagen muestra cómo la hormona se combina con el receptor para activar la proteína G. A continuación, el receptor hace que el nucleótido GDP se separe de la proteína G. El GDP es sustituido por el nucleótido GTP, que está presente en altas concentraciones dentro de la célula. Esto, a su vez, hace que la proteína G se desligue del receptor, lo que desencadena una explosión de señales en el interior de la célula. Un receptor activado provoca una reducción del apetito, y un receptor bloqueado un aumento del hambre.
© Charité l Patrick Scheerer
Estos nuevos hallazgos podrían estimular el desarrollo de fármacos optimizados para tratar a los pacientes con sobrepeso y obesidad graves. Los estudios que exploran la naturaleza de los "interruptores" del control del peso son más importantes que nunca. Tenemos que ser capaces de tratar los trastornos genéticos que provocan la incapacidad de sentir saciedad después de comer y que, incluso en enfermos jóvenes, causan una obesidad grave y difícil de tratar. Al mismo tiempo, la obesidad es uno de los retos mundiales más acuciantes. Se calcula que 1.600 millones de adultos y 650 millones de niños de todo el mundo tienen sobrepeso u obesidad. Esta afección está asociada a un mayor riesgo de comorbilidades como las enfermedades cardiovasculares y la diabetes mellitus. El aumento constante de las tasas de incidencia y las consecuencias a largo plazo están impulsando los esfuerzos mundiales de investigación para descifrar los mecanismos de regulación del apetito a nivel molecular y, en última instancia, a nivel atómico. Además de explorar el impacto de los defectos genéticos en el apetito y el hambre, los esfuerzos de investigación también se centran en encontrar posibles objetivos para intervenciones farmacológicas.
En su estudio recientemente publicado, el equipo dirigido por el Dr. Patrick Scheerer, Jefe de Cristalografía de Rayos X de Proteínas y Transducción de Señales (Laboratorio Scheerer) del Instituto de Física Médica y Biofísica de la Charité, se centró en uno de los actores clave en el control del hambre (y por tanto del peso) en los seres humanos: el receptor de melanocortina 4 (MC4R). Esta proteína receptora, que se encuentra principalmente en el cerebro, está controlada por hormonas que producen importantes señales de saciedad al unirse a ella. La activación del MC4R por parte de las hormonas estimulantes (α-/-MSH) provoca la sensación de saciedad. Por el contrario, la inhibición por el antagonista natural de la hormona, conocido como proteína relacionada con Agouti (AgRP), da lugar a un aumento de la sensación de hambre. Los defectos genéticos que provocan una alteración funcional de este "interruptor" proteico suelen dar lugar a una obesidad leve o incluso grave en los seres humanos. El Prof. Dr. Peter Kühnen, médico-científico del Instituto de Endocrinología Pediátrica Experimental, está especializado en el tratamiento de pacientes con deficiencias genéticas en la transducción de señales de saciedad. Como parte de su búsqueda de nuevas opciones de tratamiento para estos tipos de obesidad, el especialista en endocrinología ha dedicado amplios esfuerzos a estudiar las vías de señalización que subyacen a la regulación del peso corporal en el ser humano. También ha explorado las mutaciones en los genes que codifican los mensajeros y receptores celulares relevantes y ha analizado el potencial de los fármacos que podrían sustituir a los mensajeros individuales.
El tratamiento farmacológico del aumento patológico del apetito sigue enfrentándose al mismo reto: "Hasta la fecha, todas estas intervenciones farmacológicas se han visto afectadas por efectos secundarios. Éstos van desde el oscurecimiento anormal de la piel -la hormona melanocortina también es responsable de la pigmentación de la piel y el cabello- hasta eventos cardiovasculares", afirma el profesor Kühnen, que también participó en el estudio actual y cuyo trabajo de apoyo al desarrollo de nuevos fármacos de bajo efecto secundario fue galardonado con el Premio Paul-Martini en 2020. "La razón de estos efectos secundarios indeseables radica en la naturaleza de los fármacos actualmente disponibles", explica el Dr. Scheerer, líder del estudio. Y añade: "En lugar de dirigirse a un único objetivo, suelen dirigirse a una serie de receptores de la misma familia que, por desgracia, desempeñan diferentes funciones en nuestro organismo. Cuanto más sepamos sobre las interacciones entre los componentes implicados, más fácil será dirigir las intervenciones." Los equipos dirigidos por el Dr. Scheerer y el Prof. Kühnen colaboran estrechamente. Además de compartir un interés común en la traslación de los resultados de la investigación a la práctica clínica, sus esfuerzos también complementan el trabajo del Centro de Investigación Colaborativa "Dinámica estructural de la activación y señalización de los GPCR", financiado por la DFG, en la Universidad de Leipzig. Charité participa en cuatro de los subproyectos del Centro de Investigación Colaborativa.
Como parte del estudio actual, los investigadores pudieron dilucidar y visualizar la estructura molecular en 3D del receptor hormonal MC4R, un miembro de la familia de receptores acoplados a proteínas G (GPCR). Dado el diminuto tamaño de la proteína, que se expresa en dimensiones nanométricas, los métodos ópticos convencionales eran inadecuados para la tarea. "Utilizando una tecnología de imagen de última generación conocida como criomicroscopía electrónica, pudimos visualizar la estructura tridimensional del receptor con una resolución de unos 0,26 nanómetros", afirma el primer autor del estudio, Nicolas Heyder, investigador del Instituto de Física Médica y Biofísica. "Hemos visualizado las estructuras de dos complejos receptor-efector, ambos contienen la proteína G que se acopla al receptor dentro de la célula. Las diferencias entre los dos complejos se deben a que están unidos a dos hormonas diferentes, a saber, la setmelanotida y la NDP-α-MSH. Ambos recibieron su autorización de comercialización en los últimos dos años, y ambos están estabilizados por un ion de calcio en el bolsillo de unión a la hormona del MC4R". Además, los investigadores descubrieron que las estructuras de los dos receptores mostraban diferencias menores pero importantes en la forma en que se unían tanto a los fármacos como a la proteína G. "Estos detalles moleculares proporcionan información importante sobre por qué y cómo diversos ligandos -es decir, moléculas mensajeras- ejercen efectos específicos sobre diferentes vías de señalización del MC4R. Para una intervención farmacológica, esto es de gran importancia", afirma Nicolas Heyder.
Este trabajo básico sobre la naturaleza de los componentes celulares más diminutos no habría sido posible sin la criomicroscopía electrónica y los muchos años de experiencia en el establecimiento de la producción de proteínas basada en cultivos celulares. Ambos han sido objeto de una optimización continua en Charité, gracias a las colaboraciones con laboratorios y expertos líderes en el mundo, entre ellos el profesor Dr. Brian Kobilka, Premio Nobel de Química, profesor de Stanford y becario visitante Einstein en el Instituto de Salud de Berlín (BIH) en Charité. En los resultados de su estudio, los investigadores describen detalles hasta ahora desconocidos sobre los mecanismos que subyacen a la función del receptor de melanocortina 4: cómo se activa, cómo se bloquea y cómo la interacción entre una hormona y la proteína del receptor produce una señal dentro de la célula. "Ahora somos capaces de identificar las diferencias más pequeñas en las interacciones entre los receptores y las hormonas. Esto podría ser importante para el perfeccionamiento continuo de nuevos fármacos que antes se habrían asociado a efectos secundarios", afirma el Dr. Scheerer. Y añade: "Ahora que se conoce la estructura precisa del bolsillo de unión a la hormona, se puede apuntar directamente". Esto es clave para el uso traslacional del conocimiento tanto de los aspectos endocrinológicos (en este caso la regulación hormonal) como de las características estructurales de las proteínas que interactúan.
El equipo de investigación pudo demostrar que la forma en que un desactivador de receptores -o antagonista- conocido anteriormente se une al receptor es casi idéntica a la del agonista activador del receptor, con una sola diferencia significativa. "Esta diferencia señala el sitio preciso que bloquea el receptor y que contiene un interruptor sensible responsable de la activación de la proteína", explica el Dr. Scheerer. Los investigadores esperan que la investigación adicional para mejorar su comprensión del sistema de señalización MC4R les permitirá identificar los sitios potenciales para las intervenciones dirigidas. Como siguiente paso, los investigadores esperan comprender cómo otros factores podrían estar controlando el receptor a nivel molecular. Ya se han identificado algunos de los factores que interactúan directamente. Sin embargo, aún queda por dilucidar su impacto.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.