Toxina responsable del crecimiento de Legionella identificada
Un equipo de científicos dirigido por Sagar Bhogaraju, líder del grupo EMBL, e Ivan Dikic, de la Universidad Goethe de Frankfurt, descubrió que la toxina SidJ en la bacteria Legionella refuerza una modificación única en las proteínas humanas y ayuda a la legionela a crecer dentro de las células humanas. SidJ secuestra la proteína humana Calmodulin para su propia ventaja en uno de los ejemplos clásicos de bacterias patógenas que explotan la maquinaria molecular humana y la vuelven contra nosotros. Esto hace de SidJ un blanco ideal para frenar la infección por Legionella. Los resultados han sido publicados en Nature.

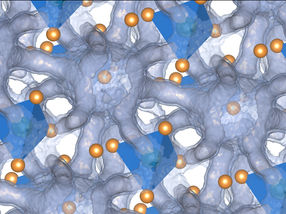
La estructura crio-EM del complejo SidJ/CaM. SidJ se muestra en cian, Calmodulin en rosa.
EMBL
Legionela - una bacteria compleja
La neumonía resultante de la exposición a la Legionella -aunque es poco común y sólo afecta a 1 de cada 100.000 personas en Europa- tiene una tasa de mortalidad superior al 10%. La bacteria patógena Legionella pneumophila tiene más de 300 toxinas que utiliza para infectar a los seres humanos. Una vez que los aerosoles que contienen la bacteria son inhalados, la Legionella entra en los pulmones donde comienza a infectar las células humanas, causando neumonía.
Las toxinas de la legionela se dirigen especialmente a las vías inmunitarias innatas, facilitando la supervivencia de las bacterias dentro de las células humanas y permitiendo la replicación de las bacterias. Debido al gran número de toxinas, es difícil ver los efectos de eliminar una o varias de estas toxinas en la capacidad de infección por Legionella. Esto se complica aún más por el hecho de que existen varias toxinas con funciones similares dentro de las bacterias. Esto hace que la Legionella sea difícil de tratar con medicamentos específicos.
Enfoque en la toxina de SidJ
Investigadores del EMBL de Grenoble y de la Universidad Goethe de Frankfurt han estudiado la toxina SidJ en detalle. Es una proteína tóxica importante de Legionella que se inyecta en el citoplasma humano y permite la infección exitosa y la replicación de la bacteria. En contraste con las otras toxinas de la Legionella, la eliminación del SidJ solo conduce a un defecto de crecimiento considerable de las bacterias en las células humanas. Esto hace de SidJ una de las toxinas más importantes de la Legionella y un objetivo atractivo para frenar la infección por Legionella.
Mientras que SidJ ha sido estudiado en el campo desde hace ya más de una década, la función precisa de la misma permaneció desconocida hasta el día de hoy. "SidJ no tiene similitud de secuencia con ninguna de las proteínas con una función conocida. Tuvimos que recurrir a métodos bioquímicos estándar y a la espectrometría de masas para determinar su función", explica Bhogaraju. "Si bien la elaboración de su mecanismo resultó ser un reto, también fue muy emocionante!"
En particular, el estudio molecular detallado de la toxina que faltaba obstaculizó el desarrollo de fármacos que pueden dirigirse a SidJ. El trabajo de científicos multidisciplinarios de los grupos Bhogaraju y Dikic describe ahora en detalle la función molecular de esta proteína, aclara su importancia para la infección por Legionella y proporciona la identidad de las proteínas humanas a las que se dirige SidJ.
Toxina en el trabajo
El grupo mostró que SidJ posee actividad de glutamilación de proteínas: une el aminoácido glutamato a una proteína objetivo como modificación post-traducción. "Este tipo de actividad es una primicia para las proteínas bacterianas", dice Ivan Dikic, Director del Instituto de Bioquímica II de la Universidad de Goethe. SidJ glutamila muchas proteínas humanas que están implicadas en la lucha contra las infecciones microbianas y la inmunidad innata. Para ello, SidJ interactúa con la proteína humana Calmodulin, una proteína mensajera de unión al calcio intermedia multifuncional altamente conservada. "La Legionella ha evolucionado inteligentemente para utilizar Calmodulin para desencadenar la actividad de SidJ y, como resultado, impide la activación de SidJ antes de que se produzca la infección en el cuerpo humano", dice Dikicic.
La estructura criogénica de la microscopía electrónica de SidJ interactuando con la Calmodulina humana también reveló que la toxina tiene un pliegue del dominio de la quinasa. "Este es un hallazgo interesante e importante, ya que el pliegue de la quinasa es drogable", dice Michael Adams, estudiante de doctorado en el grupo de Bhogaraju.
Comienzo de un largo camino hacia el uso terapéutico
El resultado del estudio va a primar muchos estudios en el futuro, diseccionando aún más el mecanismo de la glutamilación mediada por SidJ. Es importante destacar que, dado que los investigadores encontraron que SidJ tiene un pliegue de cinasa, este descubrimiento iniciará la búsqueda de una molécula de fármaco con efectos terapéuticos potenciales.
"Aunque nuestro trabajo no tiene una aplicación farmacéutica directa, nuestros resultados sobre las características estructurales y funcionales de una de las toxinas más importantes de la Legionella, darán lugar a futuros estudios destinados a dirigir esta proteína para usos terapéuticos", dice Sagar Bhogaraju.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.